
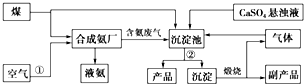
分析 (1)煤燃烧产生的烟气中含有二氧化硫、二氧化碳以及粉尘等,都可导致环境污染;
(2)CO2与CaCO3反应生成易溶的Ca(HCO3)2,亚硫酸氢钙具有还原性,可被氧化为硫酸钙;
(3)工艺操作①是从空气中分离出氮气,②操作是分离固液混合物;
(4)甲烷与水蒸气在高温、催化剂下反应生成氢气和CO;
(5)硫酸钙可与燃煤产生的CO2在一定条件下与NH3生成硫酸铵和碳酸钙;
(6)生成的碳酸钙在煅烧炉中分解为CaO和二氧化碳,二氧化碳再通入沉淀池循环利用.
解答 解:(1)煤燃烧的产物中有CO2、烟尘以及SO2,分别导致温室效应、粉尘污染和酸雨,没有营养元素排入水中,不会引起水体富营养化;
故答案为:ABC;
(2)①CO2与CaCO3反应生成易溶的Ca(HCO3)2;
故答案为:Ca( HCO3)2;
②亚硫酸氢钙具有还原性,可被氧化为硫酸钙,方程式为:Ca( HSO3)2+O2=CaSO4+H2SO4;
故答案为:Ca( HSO3)2+O2=CaSO4+H2SO4;
(3)工艺操作①是从空气中分离出氮气,将空气液化后蒸馏分离出氧气,获得氮气;硫酸钙可与燃煤产生的CO2在一定条件下与NH3生成硫酸铵和碳酸钙,碳酸钙不溶于水,分离不溶性固体和溶液的方法是过滤;
故答案为:将空气液化后蒸馏分离出氧气,获得氮气;过滤;
(4)甲烷与水蒸气在加热、催化剂下反应生成氢气和CO,化学方程式为CH4+H2O$\frac{\underline{催化剂}}{△}$CO+3H2,
故答案为:CH4+H2O$\frac{\underline{催化剂}}{△}$CO+3H2;
(5)硫酸钙可与燃煤产生的CO2在一定条件下与NH3生成硫酸铵和碳酸钙,化学方程式为CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4;
(6)硫酸钙可与燃煤产生的CO2在一定条件下与NH3生成硫酸铵和碳酸钙,生成的碳酸钙在煅烧炉中分解为CaO和二氧化碳,所以碳酸钙煅烧的副产物是CaO,另一种分解产物是二氧化碳,二氧化碳再通入沉淀池循环利用;
故答案为:CaO;CO2.
点评 本题考查三废处理及环境保护、元素化合物的性质、物质的分离提纯,把握物质的性质、环境保护及化学反应的应用等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 高锰酸钾溶液、酒精、过氧化钠都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
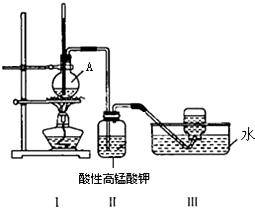 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做好空气质量预报工作,以便空气污染时及时采取防护措施 | |
| B. | 推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 | |
| C. | 将工业废水“再生”处理,用于道路保洁、城市喷泉和洗车等 | |
| D. | 利用风能、生物能发电,强制实施火力发电用煤的脱硫处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡正向移动 | C. | A的转化率降低 | D. | C的物质的量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤液化、气化,有利于提高燃料的燃烧效率,减少污染物的排放 | |
| B. | 侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 | |
| D. | 工业生产硫酸时,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com