
某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的浓度。请回答他在主要操作过程中的有关问题:
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器除天平、药匙外,还有_ __、 、 、 ;
(2)滴定:①盛装0.20mol/L的盐酸标准溶液应该用________式滴定管,②滴定时,锥形瓶中加2――3滴酚酞作为指示剂,滴定过程中,一支手控制滴定管活塞,另一支手_____________,眼睛应注视__________ ______ _,当__________时即为滴定终点;③有关数据纪录如下:
| 滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= ________ |
| 2 | 20.00 | 6.00 | 26.00 | |
(3)计算:测得NaOH溶液的浓度为 ____________mol/L,烧碱样品的纯度为 _____。
(4)若该学生测定值偏大了,则该同学引起测定误差的可能原因是____________,
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
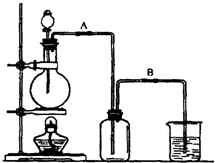 某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下:
某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下:查看答案和解析>>
科目:高中化学 来源: 题型:
某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的浓度。请回答他在主要操作过程中的有关问题:
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器除天平、药匙外,还有___ __、 、
、 ;
(2)滴定:①盛装0.20mol/L的盐酸标准溶液应该用________式滴定管,②滴定时,锥形瓶中加2――3滴酚酞作为指示剂,滴定过程中,一支手控制滴定管活塞,另一支手_____________,眼睛应注视__________ ______ _,当__________时即为滴定终点;③有关数据纪录如下:
滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
1 | 20.00 | 0.50 | 20.60 | V(平)= ________ |
2 | 20.00 | 6.00 | 26.00 | |
(3)计算:测得NaOH溶液的浓度为 ____________mol/L,烧碱样品的纯度为 _____。
(4)若该学生测定值偏大了,则该同学引起测定误差的可能原因是____________,
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的纯度。请回答他在主要操作过程中的有关问题:
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器有 ;
(2)滴定:①盛装0.20mol/L盐酸标准溶液应该用 式滴定管;
②滴定时,锥形瓶中加2-3滴 作为指示剂,滴定过程中,左手 ,右手 ,两眼应注视 ,当 时即为滴定终点;
③有关数据记录如下:
| 滴定序号 | 待测验定溶液体积 (ml) | 所消耗盐酸体积(ml) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= |
| 2 | 20.00 | 6.00 | 26.00 | |
(3)计算:测得NaOH溶液的浓度为 mol/L,烧碱样品的纯度为 。
(4)若实验指导教师测得烧碱样品的准确纯度为92.5%,则该同学引起测定误差的可能原因是
A、酸式滴定管用水洗后,未用标准酸液润洗
B、酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C、锥形瓶用蒸馏水洗后,未用碱液洗
D、酸式滴定管,起始读数俯视,滴定后读数仰视
E、在滴定过程中,向锥形瓶中添加蒸馏水
F、取待测液时,碱式滴定管未用碱液洗
G、当指示剂局部变色时,停止滴定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com