
| m |
| M |
| n |
| V |
| 6.5g |
| 65g/mol |
| 0.2mol |
| 0.1L |


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、氧化剂本身发生氧化反应 |
| B、氧化还原反应一定有氧元素参加 |
| C、氧化剂在反应中得电子,还原剂失去电子 |
| D、氧化反应一定先于还原反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验Ⅰ:制备金属钠 |
| B、实验Ⅱ:制取氢氧化亚铁并观察其颜色 |
| C、实验Ⅲ:制取少量的氢氧化铝 |
| D、实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 化学在能源开发与利用中起着十分关键的作用.
化学在能源开发与利用中起着十分关键的作用.| 金属 | 电子流动方向 | 电压/V |
| A | A-→Fe | +0.76 |
| B | Fe-→B | -0.18 |
| C | C-→Fe | +1.32 |
| D | D-→Fe | +0.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
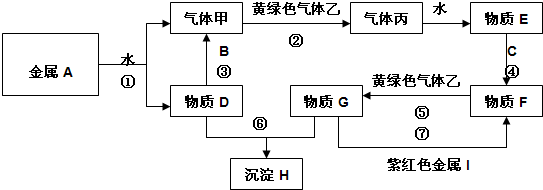
查看答案和解析>>
科目:高中化学 来源: 题型:
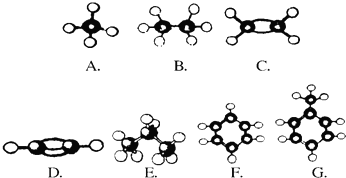
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有Cl-存在 |
| B、加入几滴Fe2(SO4)3溶液,溶液变成紫色,可确定有酚羟基存在 |
| C、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 |
| D、加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com