
【题目】下列生活中的过程或现象不属于化学变化的是
A. 天然气燃烧 B. 自然界的丁达尔效应
B. 自然界的丁达尔效应
C. 蛋白质受热凝固 D. 食醋除水垢
D. 食醋除水垢
【答案】B
【解析】
有新物质生成的变化叫化学变化,没有新物质生成的变化叫物理变化;化学变化的特征是:有新物质生成。判断物理变化和化学变化的依据是:是否有新物质生成。
A.天然气主要成分为甲烷,甲烷燃烧生成了二氧化碳和水,反应的方程式是:CH4+2O2![]()
CO2+2H2O,有新物质生成,属于化学变化,选项A不选;B.丁达尔效应为胶体独有的性质,指光照射胶体,在垂直光的传播方向有一条光亮的通路,没有新物质生成,属于物理变化,选项B选;C.蛋白质受热凝固属于蛋白质变性,性质不同于原物质,有新物质生成,属于化学变化,选项C不选;D.食醋中的醋酸能和水垢中的碳酸钙反应生成醋酸钙、水和二氧化碳,属于化学变化,选项D不选;答案选B。


科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2![]() 2NH3,有关说法正确的是
2NH3,有关说法正确的是
A. 不同的催化剂对化学反应速率影响均相同
B. 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C. 新法合成能在常温下进行是因为不需要断裂化学键
D. 哈伯法合成氨是吸热反应,新法合成氨是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH![]() +3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
+3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性:NH4+>Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、用纯净的碳酸钙粉末跟稀盐酸反应制取二氧化碳气体,请回答下列问题:
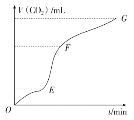
(1)实验过程如图所示,分析判断:________段化学反应速率最快。由该段图象说明:此反应属于________(填“吸热”或“放热”)反应。
(2)为了减缓上述反应的化学反应速率,欲向溶液中加入下列物质,你认为可行的是___(填字母)。
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸
(3)要减缓化学反应速率,除了上述方法外,你认为还可以采取的措施是_________。
Ⅱ、下图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。
2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。
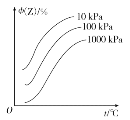
(1)若Z和X为气体,则Y为____体(填气或非气)。
(2)升高温度,v正____,v逆____(填增大或减小)。
(3)此平衡的平衡常数计算公式为:____________,温度升高,K____(填增大或减小)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为(58.5×c/ρ×1000)×100%
C. 将1 L该NaCl溶液蒸干可好到58.5c gNaCl固体
D. 20℃时,NaCl的溶解度S=(5850c/(ρ58.5))g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铁的氧化物①FeO、②Fe2O3、③Fe3O4的下列说法中正确的是( )
A.都是黑色固体
B.都不溶于水
C.铁元素化合价都相同
D.都能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是有关各种形式能量的相互转化途径的叙述,其中错误的是( )
A.家庭液化气灶将化学能转变为热能
B.灯泡将电能全部转变为光能
C.光合作用将光能转变为化学能
D.太阳能电池将光能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于特制的密优真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡NH2COONH4(s) ![]() 2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
A. 增大 B. 不变 C. 变小 D. 因条件不足无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com