
【题目】书写下列微粒的电子式:
(1)NH4+:____________; CO2:__________;NaOH:________________ 。
(2)若2.6g乙炔(C2H2气态)完全燃烧生成液态水和CO2时放热130kJ。则此反应的热化学方程式为:________。
【答案】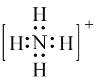
![]()
![]() C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1300kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1300kJ/mol
【解析】
(1)氮原子最外层有5个电子,与3个氢原子各形成一个共用电子对,剩下1个孤对电子,与另一个H+,形成配位键,因而电子式可表示为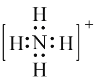 ;碳原子最外层有4个电子,与每个氧原子形成2对共用电子对,因而电子式为
;碳原子最外层有4个电子,与每个氧原子形成2对共用电子对,因而电子式为![]() ;NaOH为离子化合物,钠离子的电子式Na+,OH-的电子式为
;NaOH为离子化合物,钠离子的电子式Na+,OH-的电子式为![]() ,因而氢氧化钠的电子式为
,因而氢氧化钠的电子式为![]() 。
。
(2)2.6g乙炔为0.1mol,若2.6g乙炔(C2H2气态)完全燃烧生成液态水和CO2时放热130kJ,则1mol乙炔完全燃烧生成液态水和CO2时放热1300kJ,因而该燃烧热化学方程式为C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1300kJ/mol。


科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中进行反应:3H2(g) + N2(g)![]() 2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
A. 10 sB. 20 sC. 30 sD. 40 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《本草纲目》记载:“生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也,铜青则是铜器上绿色者,淘洗用之。”这里的“铜青”是指
A.CuOB.Cu2O
C.CuD.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义。
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) | 混合溶液的pH |
甲 | c(HY)=0.1mol/L | 0.1mol/L | pH=7 |
乙 | c(HZ)=0.1mol/L | 0.1mol/L | pH=9 |
①甲组实验中HY为_________(填强、弱)酸,0.1 moL/L HY溶液的pH=_____________。
②乙组实验中发生反应的离子方程式为_________________________________。
③乙组实验所得溶液中由水电离出的c(OH-)=________ mol/L。
(2)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示。

①滴定HCl溶液的曲线是___________(填“I”或“Ⅱ”);
②a=__________ mL。
③c(Na+)=c(CH3COO-)的点是_____________。
④E点对应离子浓度由大到小的顺序为_________________。
(3)将一定量某浓度的NaOH溶液,加入MgCO3悬浊液中,可以生成更难溶的Mg(OH)2。该反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:
(1)C元素在周期表中的位置____________。
(2)画出D元素的简单离子结构示意图_______________________。
(3)将CB2与D2以体积比1:1混合后通入品红溶液中,品红溶液不褪色,请用一个化学方程式来解释:_________________________________。
(4)AB2与水反应的化学方程式为___________,在一定温度和压强下,将一个容积为15mL的试管充满AB2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管液面仍保持在原高度,则应通入的O2为___________mL。
(5)甲、乙、丙均为含A元素的化合物,丁为单质,甲、乙、丙、丁四种物质有如下转化关系(反应条件及部分产物已略去)
![]()
①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则一个乙分子所含有的电子数目___________。
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丙的化学式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中加入4molSO2和2molO2,发生下列反应2SO2(g)+O2(g)![]() 2SO3(g),
2SO3(g),
(1)若充分反应后能否得到4molSO3?为什么?__________________________
(2)若经5s后,剩下的SO2为2.5mol,则用O2表示的反应速率是多少?5s末SO3浓度是多少?
______________、__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在容液中能大量共存的是
A. K+、CO32-、Ba2+、Cl- B. NH4+、NO3-、Na+、HCO3-
C. Fe2+、Cl-、H+、NO3- D. H+、SiO32-、K+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍。C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式)______,E、F、L所形成的简单离子的半径由小到大的顺序为(用离子符号表示)_____。
(2)由L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为____。
(3)少量固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有淡黄色沉淀产生,并无气泡冒出,请结合信息写出该反应的离子方程式 _____________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是
A | B | C | D |
|
|
|
|
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com