
����Ŀ��25Cʱ����ˮ�в��ֺ��ȵ����ֵķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵İٷ֔�) ��pH�Ĺ�ϵ����ͼ��ʾ��

����������ȷ����
A. ���Ƶ�pH=1����ˮ�У�c(C13-)>c(HClO)>c(H+)
B. ������ˮ�г���ͨ��SO2��pH���ϱ�С����Һ��ɫ���ϼ���
C. 25��ʱ��HClO![]() H++ClO-�ĵ��볣��Ka�Ķ���ֵΪlgKa=-7.54
H++ClO-�ĵ��볣��Ka�Ķ���ֵΪlgKa=-7.54
D. pH=6����ˮ�м���NaOH��Һ����Ҫ���������ӷ�Ӧ����ʽΪHClO+OH-=ClO-+H2O
���𰸡�CD
��������A���ɵ���غ㣺c(H+)=c(OH- )+c(C13-)��c(H+)>c(C13-)����A����B��Cl2��SO2��2H2O=H2SO4��2HCl��pH���ϱ�С����Һ��ɫ�������B����C��25��ʱ��HClO![]() H++ClO-�ĵ��볣��Ka=
H++ClO-�ĵ��볣��Ka=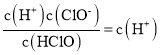 =10-7.54 ������ֵΪlgKa=-7.54����C��ȷ��D����ͼ����pH��HClO��Ũ�ȱ�С���Ƿ�Ӧ�ClO-����������������Ҫ���������ӷ�Ӧ����ʽΪHClO+OH-=ClO-+H2O����D��ȷ����ѡCD��
=10-7.54 ������ֵΪlgKa=-7.54����C��ȷ��D����ͼ����pH��HClO��Ũ�ȱ�С���Ƿ�Ӧ�ClO-����������������Ҫ���������ӷ�Ӧ����ʽΪHClO+OH-=ClO-+H2O����D��ȷ����ѡCD��


 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʢ�������������IJ������ڣ� ��
A. �Ͻ���� B. �ϳɸ߷��Ӳ��� C. ��Ȼ�߷��Ӳ��� D. ���ǽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18molL��1Ũ��������100mL3.0molL��1ϡ�����ʵ�鲽�����£�
��1�����䲽��
�ټ�������Ũ��������������ȡһ�������Ũ������ܽ⣻������ת�ơ�ϴ�ӣ� ���ݡ�ҡ�ȣ� ��װƿ����ǩ��
����������⣺
��2������Ũ���������� �� ��ȡŨ�������õ���Ͳ�Ĺ��������������ѡ��A��10mL B��25mL C��50mL D��100mL����
��3���ڢ۲�ʵ��IJ����� ��
��4����������������Ƶ�ϡ����Ũ���к�Ӱ�죿���á�ƫ��ƫС������Ӱ�족��д��
A�����õ�Ũ���᳤ʱ��������ܷⲻ�õ���������
B������ƿ������ˮϴ�Ӻ������������ˮ��
C�����ù����ձ���������δϴ����
D������ʱ���ӿ̶��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���仯�����ڹ�ũҵ������Ҫ���á�
������һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g�� ![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
T/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��___________���÷�ӦΪ__________��������������������������Ӧ��
��2��ij�¶���ƽ��Ũ�ȷ�����ʽ�� c��CO2����c��H2����c��CO����c��H2O�������¶��¼���1 mol CO2��g����1 mol H2��g������ַ�Ӧ���ﵽƽ��ʱ��CO2��ת����Ϊ______________��
��3����800 ��ʱ����������Ӧ��ijʱ�̲�������ڸ����ʵ�Ũ�ȷֱ�Ϊc��CO2��Ϊ2 mol/L��c��H2��Ϊ1.5 mol/L��c��CO��Ϊ1 mol/L��c��H2O��Ϊ3 mol/L���������淴Ӧ���ʵıȽ�Ϊ��v��___________v������������������������������
��ҵ����CO2��H2��Ӧ�ϳɼ��ѡ���֪��
CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H1=-53.7kJmol-1
CH3OCH3��g��+H2O��g���T2CH3OH��g����H2=+23.4kJmol-1
��2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����H3=_______________kJ��mol-1��
CH3OCH3��g��+3H2O��g����H3=_______________kJ��mol-1��
�������ð�ˮ����CO2�ɵõ�NH4HCO3��Һ���ڸ���Һ�У�c��NH4+��________������>������<������������c��HCO3��������ӦNH4+��HCO3����H2O![]() NH3��H2O��H2CO3��ƽ�ⳣ��K��__________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10��5��H2CO3�ĵ���ƽ�ⳣ��K1��4��10��7��K2
NH3��H2O��H2CO3��ƽ�ⳣ��K��__________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10��5��H2CO3�ĵ���ƽ�ⳣ��K1��4��10��7��K2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪KMnO4 ��Ũ���ᡢ˫��ˮ�dz�������������ijС��ͬѧ����ͼװ����Ũ������ľ̿��Ӧ��ʵ�飬�Լ��������ɵ�CO2��SO2���ݴ˻ش��������⣺
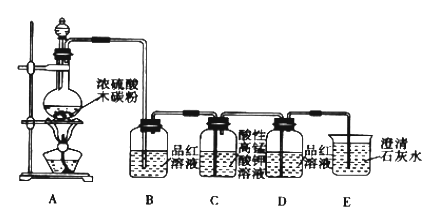
��1��ľ̿��ŨH2SO4�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ��__________________________��
��2��װ��B�۲쵽��������Ʒ����Һ��ɫ����ȷ���������к���_________________��˵�����������___________�ԣ�
��3��װ��C���Ϻ�ɫ��ȥ��������SO2�Ļ�ԭ�ԣ�MnO4������ԭΪMn2+����Ӧ�����ӷ���ʽΪ________________________����ԭ���������������ʵ���֮��Ϊ_________��
��4��װ��E�۲쵽��������_______________________����װ���з��������ӷ���ʽ��____________________________��
��5������װ��A�����ɵ�����ͨ��BaCl2��Һ���Ƿ����������________��������������������,���ͨ��Ba��NO3��2��Һ�в��������Ļ�ѧʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܵĻ������ڴ��Բ���������������졢�����Ʊ��ȷ���Ӧ�÷dz��㷺��
��1��Co2+��̬��������Ų�ʽΪ_________��
��2���Ʊ�[Co(H2O)6]2+��ӦΪ(NH4)2[Co(SCN)4] +6H2O= [Co(H2O)6(SCN)2+2NH4SCN��
�������[Co(H2O)6]2+����Co2+�γ���λ����ԭ����________����Ԫ�ط���)��SCN-�Ŀռ乹��Ϊ________(����������)��
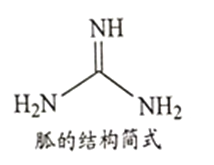
��NH4SCN��180-190���ֽⲢ�Ƶ���(�ṹ��ʽ��ͼ��ʾ)���ҷ����е�ԭ���ӻ��������Ϊ_________�� 1mol ���к�������ĿΪ________��
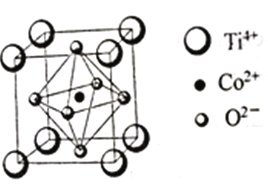
��3��һ���ܵĻ����������ʯ������Ĵ������侧���ṹ��ͼ��ʾ����������ÿ��O2-���ڵ�O2-��______��(������)��
��������������ɫ����Һ�壬�е�142����������ʳƷ���ϡ��ϳɷ�������:
CH3COOH+HO(CH2)2CH(CH3)CH3 ![]() CH3COO(CH2)2CH(CH3)CH3+H2O
CH3COO(CH2)2CH(CH3)CH3+H2O
����1.��ȡ26.4g (0.3mol) �����촼��21.6g (0.36mol) ���ᣬ����������ƿ�У���������FeCl3��6H2O �ͼ�����ʯ��
����2.װ���¶ȼƺ�����B (����ͼ)������1h��
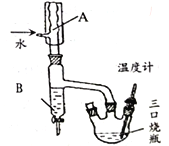
����3.���������B ��Ϊ����װ�ã��ռ�����ݡ�
����4.��Ӧ������ֱ��ñ���ʳ��ˮ��̼��������Һ��ˮ�ֱ�ϴ�ӡ���Һ��
����5.����2g ��ˮMgSO4����һ�������õ�������������
��1��ͼ������A����Ϊ______������B ��������_______
��2������1����Ͷ�ϱ�n(����)/n(���촼)=1.2����Ŀ����__________
��3������4����̼��������Һ��ϴ�ӵ�Ŀ����_______�� ��Һʱ�õ�����Ҫ����������______ (д����)��
��4������5 ��MgSO4�����_________�õ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18molL��1Ũ��������100mL3.0molL��1ϡ�����ʵ�鲽�����£�
��1�����䲽��
�ټ�������Ũ��������������ȡһ�������Ũ������ܽ⣻������ת�ơ�ϴ�ӣ� ���ݡ�ҡ�ȣ� ��װƿ����ǩ��
����������⣺
��2������Ũ���������� �� ��ȡŨ�������õ���Ͳ�Ĺ��������������ѡ��A��10mL B��25mL C��50mL D��100mL����
��3���ڢ۲�ʵ��IJ����� ��
��4����������������Ƶ�ϡ����Ũ���к�Ӱ�죿���á�ƫ��ƫС������Ӱ�족��д��
A�����õ�Ũ���᳤ʱ��������ܷⲻ�õ���������
B������ƿ������ˮϴ�Ӻ������������ˮ��
C�����ù����ձ���������δϴ����
D������ʱ���ӿ̶��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ�ּ���������ˮ���������Ϳ�ϡ�����������Ӧ�÷dz��㷺��һ������ͭ��ʯ(��CuFeS2��Cu2S ��) Ϊԭ����ȡCu2O �Ĺ�����������:
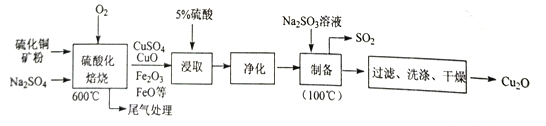
��1�������ữ������ʱ������ͭ��������Ŀ����_________����CuS ��O2��Ӧ����CuSO4�����ʵĻ�ѧ����ʽΪ________���ۼ���Na2SO4�����ó���С���ϼ����⣬��һ��Ҫ������__________��
��2������ȡ��ʱΪ���ͭ�Ľ�ȡ�ʣ�������������Ũ���⣬�������_________ (�����о�����)��
��3�����Ʊ���ʱ����Һ��pH��Cu2O �IJ��ʹ�ϵ����ͼ��ʾ��
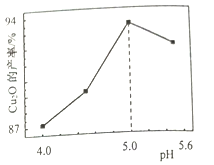
����100��ʱ��������Ӧ�����ӷ���ʽΪ__________
��ͼ����4<pH<5 ʱ��pHԽС����Խ���Ҳ�Ʒ������Cu�ĺ���Խ�ߣ�����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��3�Ĵ����pH��3������������Һ�������й���������Һ��������ȷ������ ��
A. ����Һ��ˮ�������c(H��)��1��10��11mol/L
B. ��ˮϡ��100��������ҺpH����ͬ
C. �״���c(CH3COO��)�������е�c(SO![]() )��ͬ
)��ͬ
D. ����Һ�зֱ��������пƬ�ų�H2�����ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com