
������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NO2���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⡣
I����������װβ������װ�ã���ʹCO��NOx�ж��������Ӧת��Ϊ�����塣
2xCO��2NOx ==2xCO2��N2
��ת�Ƶ������ʵ���Ϊ0.8x molʱ���÷�Ӧ���� LN2(��״����)��
II��һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ����Ի�ԭ������������������ϳɺܶ��л�����״���CH3OH���������ѣ�CH3OCH3���ȣ���������ȼ�ϡ�
��1����ѹǿΪ0.1 MPa�����£���a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״��� CO(g)��2H2(g)  CH3OH(g)�� ��H<0
CH3OH(g)�� ��H<0
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1 mol CO��3 mol H2
��2����֪����CO(g)��2H2(g) CH3OH(g) ��H����90.7 kJ·mol��1
CH3OH(g) ��H����90.7 kJ·mol��1
��2CH3OH(g) CH3OCH3(g)��H2O(g) ��H����23.5 kJ·mol��1
CH3OCH3(g)��H2O(g) ��H����23.5 kJ·mol��1
��CO(g)��H2O(g) CO2(g)��H2(g) ��H����41.2 kJ·mol��1
CO2(g)��H2(g) ��H����41.2 kJ·mol��1
��3CO(g)��3H2(g) CH3OCH3(g)��CO2(g)�ġ�H�� ��
CH3OCH3(g)��CO2(g)�ġ�H�� ��
��3��CO—����ȼ�ϵ����ʹ�õĵ�����Dz���Y2O3��ZrO2���壬���ڸ������ܴ���O2—��
�õ�ظ����ĵ缫��ӦʽΪ ��
��4���״�Ҳ������Դ��ص�ȼ�ϣ�������ˮ�ʻ����һ����
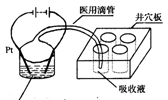 ��Ⱦ����һ�ֵ绯ѧ��������������Ⱦ����ԭ���ǣ�2�μ״���1mL 1.0mol·L—1���ᣬ4mL 0.1mol·L—1�����ܣ�CoSO4�������Һ�������������Ե缫��ͨ���Co2+������Co3+��Ȼ����Co3+����������ˮ�еļ״���
��Ⱦ����һ�ֵ绯ѧ��������������Ⱦ����ԭ���ǣ�2�μ״���1mL 1.0mol·L—1���ᣬ4mL 0.1mol·L—1�����ܣ�CoSO4�������Һ�������������Ե缫��ͨ���Co2+������Co3+��Ȼ����Co3+����������ˮ�еļ״��� ����CO2��������ʵ��������ͼװ��ģ���������̣�
����CO2��������ʵ��������ͼװ��ģ���������̣�
�ټ�����ʱ������CO2���壬��Ѩ��Ѩ����Ӧʢ�� ��Һ��
��д�������״������ӷ���ʽ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�������ֵ������˵����ȷ���� �� ��
A�����³�ѹ�£�17g��(��14CH3)�����ĵ�����Ϊ10NA
B��pH=1��ϡ�����к��е�H+ ��Ϊ0.1NA
C��7.8g��������������������̼��Ӧת�Ƶĵ�����Ϊ0.1NA
D��3mol NO2������H2O��Ӧ��ת��NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���г�������ȷ�����������ϵ���ǣ�
| ѡ�� | ������ | ������ |
| A | Cl2�������� | Cl2��ʹʪ��ĺ�ɫ������ɫ |
| B | SO2��Ư���� | SO2��ʹ����KMnO4��Һ��ɫ |
| C | Al�л�ԭ�� | �������ȷ�Ӧұ������Mn |
| D | Fe3+�������� | Fe3+��KSCN��Һ��Ѫ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������Խ��Al-AgO��ؿ�����ˮ�¶�����Դ����ԭ����ͼ��ʾ��
�õ�ط�Ӧ�Ļ�ѧ����ʽΪ��2Al��3AgO��2NaOH=2NaAlO2��3Ag��H2O��
 ������˵����ȷ����
������˵����ȷ����
A���ø�Ĥ�������ӽ���Ĥ
B�������ĵ缫��ӦʽΪ��O2+2H2O+4e��=4OH��
C��Al�缫�ķ�ӦʽΪ��Al-3e��+4OH��= AlO2�� +2H2O
D�����缫������0.54 g Agʱ����·��ת�Ƶĵ���Ϊ0.005mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����IJ����Ǻ���һ�����һ���ˮƽ�ı�־��2SO2(g) + O2(g)  2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
| �� | �� | �� | ||
| ��ʼ���ʵ��� | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2��ƽ��ת���� | 80% | ��1 | ��2 |
�����ж��У���ȷ����
A�����з�Ӧ��ƽ�ⳣ��С���� B��ƽ��ʱ������c(SO3)�Ǽ��е�2��
C�����¶��£�ƽ�ⳣ��ֵΪ400 D��ƽ��ʱ��SO2��ת���ʣ���1<80%<��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������彡����ɽϴ�Σ������
A����SO2Ư��ľ���Ƴ�����
B����Ư��[Ca(ClO)2]ϡ��Һ�Բ;߽���ɱ������
C����ʳ����ϴ��ˮƿ���ڱڸ��ŵ�ˮ��(CaCO3)
D����С�մ�NaHCO3����������������ͷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ����
A. Fe��������ȼ������FeCl2
B ��AlCl3��Һ��ε��뵽NaOH��Һ���Ȳ�����ɫ��������������ʧ
C�������л������ۼȿ��ù�����NaOH��Һ��Ҳ�����ù���FeCl3��ַ�Ӧ���˳�ȥ
D�������£�����Ʒ��Ũ�����Ũ���ᴦ����������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����( )
A��֬��������������±������������
B����Ȼ����������ˮú�������ڿ������������
C����ҵ�Ϸֱ����Ȼ�ԭ�����ȷֽⷨ�͵�ⷨұ��ͭ��þ����
D�����ǡ����ᱵ��ˮ�ֱ����ڷǵ���ʡ�ǿ����ʺ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ����˫Ӯ�Ŀ��⡣

��1��CO�����ںϳɼ״���������ɱ���ܱ�����
�г���4molCO��8molH2���ڴ��������ºϳɼ״���
CO��g��+2H2��g�� CH3OH��g��(��)��ƽ��ʱCO
CH3OH��g��(��)��ƽ��ʱCO
��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
�ٸ÷�Ӧ���淴Ӧ����________��Ӧ��������ȡ���
�����ȡ�����
����0.1Mpa ��100��������£��÷�Ӧ�ﵽƽ��ʱ��
�����Ϊ��ʼ���������_________���������������λС���㣩
�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���4molCO��8molH2���ﵽƽ��ʱCOת����_______������������䡱��С������ ƽ�ⳣ��K_______������������䡱��С������
��2���ڷ�Ӧ(��)����Ҫ�õ�H2����Ӧ��Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4��g��+ H2O��g��= CO��g��+3H2��g�� ��H=+206.2 kJ��mol-1
CH4��g��+ CO2��g��= 2CO��g��+2H2��g�� ��H=+247.4 kJ��mol-1
��CH4��H2O��g����Ӧ����CO2��H2���Ȼ�ѧ����ʽΪ�� ��
��3���ڷ�Ӧ(��)���Ƶõ�CH3OH ��������ȼ�ϣ���������������ɼ���ȼ�ϵ�أ��������Һ��20����30����KOH��Һ�����ȼ�ϵ�طŵ�ʱ�������ĵ缫��ӦʽΪ_______________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com