
| A. | 0.1 mol•L-1 NaA溶液pH=10 | B. | 0.01 mol•L-1 HA溶液的pH=4 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | HA溶液跟锌反应,放出H2很慢 |
分析 要证明一元酸HA为弱酸,可通过证明以下方法:①证明HA在溶液中不能完全电离、存在电离平衡,②HA对应的强碱盐溶液呈碱性等,以此解答该题.
解答 解:A.0.1 mol•L-1 NaA溶液pH=10,说明NaA为强碱弱酸盐,水解呈碱性,可证明HA为弱酸,故A不选;
B.0.01 mol•L-1 HA溶液的pH=4,说明HA没有完全电离,可证明HA为弱酸,故B不选;
C.常温下,将pH=2的HA溶液稀释100倍,测得pH=3.5,说明加水稀释促进电离,如为强酸,稀释后pH=4,所以可证明为弱酸,故C不选;
D.HA溶液跟锌反应,生成氢气的快慢与溶液的浓度有关,不能根据放出H2很慢,判断为弱酸,如果是强酸浓度很小生成氢气的速率也很小,故D选;
故选D.
点评 本题考查弱电解质的电离平衡及其应用,题目难度中等,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
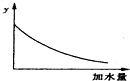
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-=Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
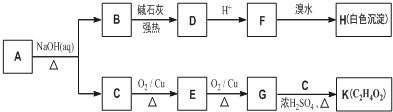
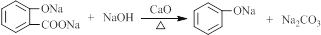 .
.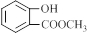 .
.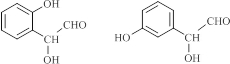 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

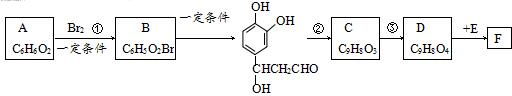
 ;D
;D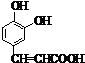 .
.
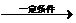
 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.16g | B. | 1.08g | C. | 2.7g | D. | 5.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,K值越大 | B. | K值越大,正反应速率越大 | ||
| C. | K值的大小与起始浓度有关 | D. | K值越大,反应物的转化率越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com