
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.H2、I2、HI平衡混和气加压后颜色变深 |
| D.打开啤酒瓶盖,瓶口冒出大量气泡 |
科目:高中化学 来源:不详 题型:单选题
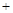 NO2(g)
NO2(g)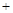 2NH3(g)
2NH3(g) 2N2(g)
2N2(g)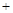 3H2O(g),相关说法正确的是 )
3H2O(g),相关说法正确的是 )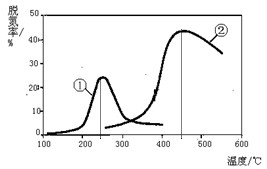
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g) 在恒温下已达到平衡的是( )
C(g)+D(g) 在恒温下已达到平衡的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.工业上合成NH3反应使用催化剂 |
| C.实验室可以采用排饱和食盐水收集Cl2 |
| D.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3
2NH3| A.N2、H2、NH3的浓度不再发生变化 | B.N2、H2、NH3的分子数相等 |
| C.单位时间内生成a mol N2,同时生成3a mol H2 | D.容器中的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是| A.正反应速率等于逆反应速率,且不等于零 |
| B.X的浓度不再发生变化 |
| C.Y的浓度不再发生变化 |
| D.Z的浓度不再发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com