
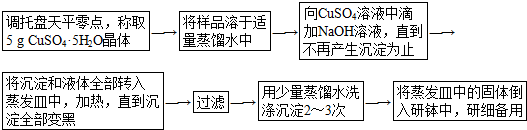
分析 (1)若指针偏向右边,说明右边重,左边轻;
(2)加速固体物质的溶解;
(3)硫酸铜与氢氧化钠反应生成氢氧化铜与硫酸钠;
(4)受热均匀,防止液体飞溅;
(5)过滤中用玻璃棒引流;
(6)除去沉淀中夹杂的可溶性杂质;向过滤器中加入蒸馏水浸没沉淀,等待水自然流尽后,重复操作2~3次;用氯化钡溶液检验最后一次洗涤液是否含有硫酸根离子;
(7)计算硫酸铜晶体的物质的量,根据方程式计算需要氢氧化钠物质的量,进而计算氢氧化钠的物质的量浓度.
解答 解:(1)若指针偏向右边,说明右边重,左边轻,应将左边的螺丝向右旋动,故答案为:向右;
(2)溶解样品时要用到玻璃棒,其作用是:搅拌,加速固体物质的溶解,
故答案为:搅拌,加速固体物质的溶解;
(3)硫酸铜与氢氧化钠反应生成氢氧化铜与硫酸钠,离子方程式为:Cu2++2OH-═Cu(OH)2↓,
故答案为:Cu2++2OH-═Cu(OH)2↓;
(4)加热蒸发过程中要用到玻璃棒,其作用是:搅拌,防止因局部过热引起液体物质飞溅,
故答案为:搅拌,防止因局部过热引起液体物质飞溅;
(5)过滤中要用到玻璃棒,其作用是:引流,
故答案为:引流;
(6)洗涤沉淀的目的是:除去沉淀中夹杂的可溶性杂质;洗涤沉淀的方法是:向过滤器中加入蒸馏水浸没沉淀,等待水自然流尽后,重复操作2~3次;为了检验沉淀是否洗涤干净,应在最后一次的洗涤液中加入BaCl2溶液,
故答案为:除去沉淀中夹杂的可溶性杂质;向过滤器中加入蒸馏水浸没沉淀,等待水自然流尽后,重复操作2~3次;BaCl2;
(7)硫酸铜晶体的物质的量为$\frac{5g}{250g/mol}$=0.02mol,则CuSO4为0.02mol,由CuSO4+2NaOH=Cu(OH)2↓+Na2SO4可知,需要NaOH物质的量为0.02mol×2=0.04mol,则NaOH溶液的物质的量浓度至少为 $\frac{0.04mol}{0.1L}$=0.4mol/L,
故答案为:0.4mol/L.
点评 本题以氧化铜的制备为载体,考查物质的分离提纯、天平使用、物质的量浓度计算等,侧重对实验基本操作的考查,比较基础.


科目:高中化学 来源: 题型:选择题
| A. | HX、HY、HZ | B. | HX、HZ、HY | C. | HZ、HY、HX | D. | HY、HZ、HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂试剂 | 操作方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙 | 过滤 |
| B | NaCl溶液 | NaBr | 稍过量氯水、乙醇 | 萃取、分液 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液 | 过滤 |
| D | O2 | CO | 氧化铜 | 通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与醋酸:CO32-+2CH3COOH═2CH3COO-+H2O+CO2↑ | |
| B. | 碳酸氢铵溶液与足量NaOH溶液:HCO3-+OH-═H2O+CO32- | |
| C. | 用醋酸除水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1与pH=2的CH3COOH)溶液中,c(H+)浓度之比为1:10 | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Li2NH中N的化合价是-1 | B. | 该反应中H2既是氧化剂又是还原剂 | ||
| C. | H-的离子半径比Li+大 | D. | 此法储氢和钢瓶储氢的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HB-)+2c(H2B)=c(OH-) | B. | c(Na+)+c(OH-)=c(H+)+c(HB-) | ||
| C. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | D. | 2c(B2-)+2c(HB-)=0.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com