
【题目】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如下转化:下列相关离子方程式或化学方程式错误的是( )

A. ①可能为CH4+Cl2![]() CH3Cl+HClB. ①可能为Fe+2Fe3+=3Fe2+
CH3Cl+HClB. ①可能为Fe+2Fe3+=3Fe2+
C. ②可能为2NO+O2=2NO2D. ②可能为CO32-+H2O+CO2=2HCO3-
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=___kJ·mol-1(用含a、b的代数式表示);
(2)已知2SO2(g)+O2(g)=2SO3(g) △H反应过程的能量变化如图所示,已知1molSO2(g)氧化为1molSO3放出99kJ的热量,请回答下列问题:
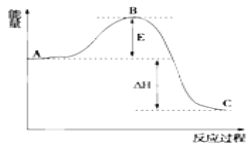
①图中A分别表示____;
②E的大小对该反应的反应热____(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“升高”“降低”)。
Ⅱ.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。请回答下列问题:
(3)有机物M经过太阳光光照可转化成N,转化过程如图:
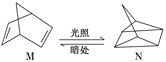 ΔH=+88.6 kJ/mol
ΔH=+88.6 kJ/mol
则M、N相比,较稳定的是___。
(4)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-akJ/mol,则a__238.6(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是非常有用的材料,以下是四种金属的相关性质。
金属 | 熔点(℃) | 密度(g/cm3) | 相对强度 (1表示很弱) | 相对硬度 (1表示很软) | 每吨价格 (元) |
铝 | 660 | 2.7 | 11 | 2.8 | 11400 |
铜 | 1085 | 8.9 | 33 | 3.0 | 38000 |
铁 | 1538 | 7.9 | 20 | 4.5 | 4000 |
钛 | 1668 | 4.5 | 40 | 6.0 | 160000 |
完成下列填空:
(1)铝用作电线是利用了铝的_________性;铁用作炊具是利用了铁的_________性。
(2)工业上常以Cu为原料制备CuSO4,“绿色化学”要求从经济、技术和环保来设计可行的化学反应,生产应尽量减少对环境的副作用。下列反应符合“绿色化学”的是(_______)
A.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
B.2Cu + O2![]() 2CuO,CuO + H2SO4→CuSO4 +H2O
2CuO,CuO + H2SO4→CuSO4 +H2O
(3)常温下由于浓硫酸能使铁___________,因此浓硫酸可用铁槽车运输。
(4)钛是制造飞机的材料之一。根据表中数据,解释为何用钛来制造飞机。______________
(5)钢是主要含有铁的合金。汽车车身可以用铝或钢制造。已知铁在潮湿的空气中会迅速腐蚀,而铝不会。请解释铝耐腐蚀的原因。_______________________________________
(6)根据表中数据,描述用铝来取钢制造汽车车身的一项优点和一项缺点。
优点:_____________________________________________________________________
缺点:_____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液中有关浓度关系不正确的是( )
A. 浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-)
B. 0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L
D. NH4+浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如图所示:
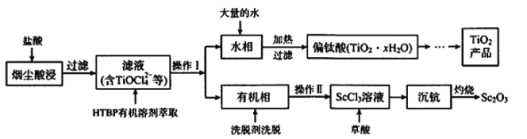
(1)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为_____。
(2)“水相”的主要离子有TiOCl42-、H+、Cl-及Mg2+,写出加入大量的水并加热发生的相关离子反应方程式_____。
(3)酸浸过程中,稍过量的盐酸的作用除溶解吸收烟尘外,另外还有的作用是_______。
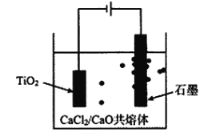
(4)钛的冶炼新法是剑桥电解法(如图)。以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。利用中学所学知识可以预测CaCl2的作用包含增强导电性及______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含碳酸钠杂质的氯化钠样品10克,与足量的盐酸反应,生成的气体在标准状况下体积为224mL,求:
(1)生成的气体是______________,物质的量为____________。
(2)该样品中含氯化钠的质量分数?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H2(标准状况),此时电解质溶液(体积变化忽略不计)的pH为( )
A. 13B. 12C. 8D. 1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com