
| A. | 氯化氢的电子式: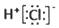 | |
| B. | 质子数为6,中子数为8的核素:${\;}_{6}^{14}$C | |
| C. | Na+的结构示意图: | |
| D. | CH4分子的球棍模型: |
分析 A.HCl为共价化合物;
B.质子数为6,中子数为8的核素,为碳元素,质量数为14;
C.钠的质子数为11;
D. 为比例模型.
为比例模型.
解答 解:A.氯化氢为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为 ,故A错误;
,故A错误;
B.质子数为6,中子数为8的核素,为碳元素,质量数为14,可表示为${\;}_{6}^{14}$C,故B正确;
C.钠的质子数为11,Na+的结构示意图应为 ,故C错误;
,故C错误;
D.甲烷为正四面体结构,甲烷的球棍模型为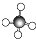 ,故D错误.
,故D错误.
故选B.
点评 本题综合考查化学用语,为高频考点,涉及电子式、离子结构示意图、球棍模型以及结构简式等知识,难度不大,注意掌握电子式、分子式、结构简式、结构式的概念及区别,明确球棍模型与比例模型的表示方法.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
 (称为羟醛缩合反应)
(称为羟醛缩合反应)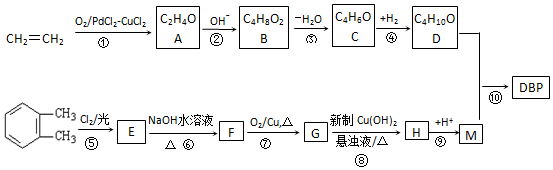
 .
. .
.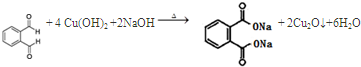 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加硫酸钠溶液,有白色沉淀生成,则证明原溶液中一定有Ba2+ | |
| B. | 气体通过CuSO4粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液中加入稀硫酸,放出无色无味气体,将该气体通入澄清石灰水,溶液变浑浊,证明原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2I-+Cl2═I2+2Cl- | |
| B. | 2Fe2++2Br-+2I-+3Cl2═2Fe3++I2+Br2+6Cl- | |
| C. | 2Fe2++4Br-+2I-+4Cl2═2Fe3++I2+2Br2+8Cl- | |
| D. | 4Fe2++2Br-+2I-+4Cl2═4Fe3++I2+Br2+8Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| R | W |
| A. | X,Y、R,W四种元素的原于半径依次增大 | |
| B. | Z、W元素与X均可以形成AB2型化合物 | |
| C. | Y元素的最高价氧化物的水化物和其氢化物反应的生成物中仅含有共价键 | |
| D. | Z的氢化物的稳定性大于W的氢化物,是因为Z的氢化物分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com