
| A、H2S |
| B、Fe2(SO4)3 |
| C、Ba(OH)2 |
| D、NaCl |


科目:高中化学 来源: 题型:
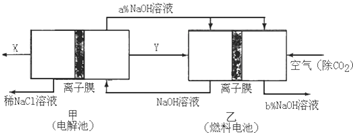
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、NF3是极性分子,在干燥空气中泄漏会看到红棕色气体 |
| C、若生成1mol HNO3,转移2NA个电子 |
| D、每消耗0.02mol氧化剂,可收集到2.24L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol NH3所含有的原子数为NA |
| B、常温常压下,22.4L氧气所含的原子数为3NA |
| C、常温常压下,48gO2和O3的混合气中含有的氧原子数为3NA |
| D、1mol/L的NaCl溶液中所含Na+为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池工作时,正极和负极上不一定都发生氧化还原反应 | |||
B、xLi+Li1-xNiO2
| |||
| C、在铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1120 mL(标准状况)气体析出 | |||
| D、在理论上可将该反应:CH4(g)+2O2(g)→CO2(g)+H2O(l)△H<0,设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
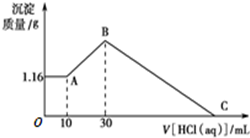 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com