
| 初始浓度(mol/L) | 平衡浓度(mol/L) | ||||
| c0(N2) | c0(H2) | c0(NH3) | c平(N2) | c平(H2) | c平(NH3) |
| 2.48 | 4.34 | 0 | 1.85 | 2.43 | 1.27 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.8 | 6.0 |
| 变化量 |
| 初始量 |
| 生成物平衡浓度系数次幂之积 |
| 反应物平衡浓度系数次幂之积 |
| 0.63 |
| 2.48 |
| c2(NH3) |
| c(N2)?c3(H2) |
| 1.272 |
| 1.85×2.433 |


科目:高中化学 来源: 题型:
| A、利用相对分子质量大小可以判断某些物质的熔沸点高低 |
| B、利用密度数据可判断液体物质挥发性的大小 |
| C、利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D、利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
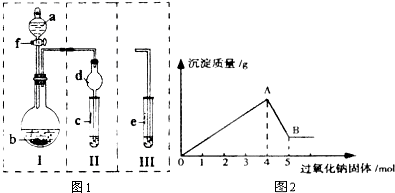
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在由水电离产生的氢离子浓度为10-13mol?L-1的溶液中,Ca2+、K4、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp=6.82x10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 |
| C、对于反应N2H4(l)=N2(g)+2H2(g);△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2mol?L-1某一元碱(ROH)溶液和0.1mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
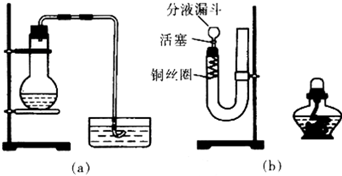
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com