
分析 电解混合溶液时,阴极发生Ag++e-=Ag,阳极发生:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,电解一段时间后阴极析出3.24克金属,即析出的是金属Ag,结合两极转移电子数目相等和电极方程式分析,并进行计算.
解答 解:0.06molAgNO3和0.02molKCl混合溶液中含有银离子的物质的量是0.06mol,含有氯离子的物质的量是0.02mol,阴极发生Ag++e-=Ag,阴极析出3.24g即0.03mol金属Ag,消耗银离子是0.03mol,转移电子是0.03mol,在阴极上银离子有剩余,在阳极上发生:2Cl--2e-=Cl2↑,氯离子的物质的量是0.02mol,全部失电子,转移电子是0.02mol,所以还会发生反应:4OH--4e-=O2↑+2H2O,转移电子0.01mol,消耗氢氧根离子是0.01mol,所以溶液中氢离子浓度是$\frac{0.01mol}{0.3L}$≈0.03mol/LpH=2-lg3=1.7,答:此时溶液的PH值为1.7.
点评 本题以电解原理为载体考查了物质的量的有关计算,明确离子放电顺序是解本题关键,结合转移电子守恒确定阳极上放电的离子,根据物质之间的关系式来分析解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
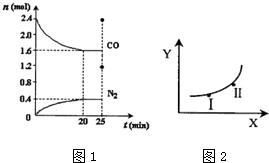
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗和烧杯分离水和乙酸乙酯的混合物 | |
| B. | 用瓷坩埚熔融烧碱 | |
| C. | 用玻璃棒蘸少量待测物质的浓溶液做焰色反应 | |
| D. | 将pH试纸直接插入溶液中测量某溶液pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论在什么条件下,c(H+)增大,酸性都增强 | |
| B. | 稀释氯化铵溶液,水的电离程度变大 | |
| C. | 稀释氢氧化钠溶液,水的电离程度变小 | |
| D. | 升高温度,KW变大,H+浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | A | B | C | |||||
| 三 | D | E | F | G |
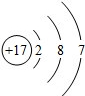 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.| 压强/MPa SO2转化率 温度/℃ | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 35℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2molH2 | 2mol CH3OH | 2mol CH3OH | |
| 平 均 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | aKJ | bKJ | cKJ | |
| 体系压强 | P1 | P2 | P3 | |
| 反转化率应物 | a1 | a2 | a3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com