
【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。

(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。
【答案】分液漏斗 品红溶液褪色 还原性 SO2+2H2S=3S↓+2H2O 安全瓶或防倒吸 不能 SO2与NaOH反应无明显现象 2H2SO3+O2=2H2SO4或2SO2+O2+2H2O=2H2SO4 水分蒸发使c(H+)浓度增大
【解析】
由实验装置分析可知,A为浓硫酸和Cu在加热的条件下制取SO2气体的装置,发生反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,B为验证SO2的漂白性的装置,C为验证SO2的还原性的装置,D为验证SO2氧化性的装置,E为尾气处理装置,据此分析解答。
CuSO4+SO2↑+2H2O,B为验证SO2的漂白性的装置,C为验证SO2的还原性的装置,D为验证SO2氧化性的装置,E为尾气处理装置,据此分析解答。
(1)根据仪器构造可知,仪器a为分液漏斗,根据上述分析可知,A装置制取SO2气体,由于SO2具有漂白性,因此SO2能使B装置中的品红溶液褪色,故答案为:分液漏斗;品红溶液褪色;
(2)装置C中氯水褪色,说明氯水中的Cl2被还原,证明SO2具有还原性,故答案为:还原性;
(3)SO2具有氧化性,可与H2S发生归中反应生成S单质,反应的化学方程式为SO2+2H2S=3S↓+2H2O,故答案为:SO2+2H2S=3S↓+2H2O;
(4)SO2易溶于水,为防止倒吸,应在A、B间应增加F装置,保证实验的安全性,故答案为:安全瓶或防倒吸;
(5)由于SO2与NaOH反应无明显现象,因此不能通过装置E来证明SO2是酸性氧化物,故答案为:不能;SO2与NaOH反应无明显现象;
(6)由于SO2与水反应生成的H2SO3具有还原性,易被空气中的氧气氧化生成酸性更强的H2SO4,反应方程式为2H2SO3+O2=2H2SO4或2SO2+O2+2H2O=2H2SO4,所以酸雨样品随着时间的推移pH会变小,同时水分蒸发使c(H+)浓度增大,pH会再次减小,故答案为:2H2SO3+O2=2H2SO4或2SO2+O2+2H2O=2H2SO4;水分蒸发使c(H+)浓度增大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.11 g硫化钾和过氧化钾的混合物,含有的离子数目为0.4NA
B.28 g聚乙烯(![]() )含有的质子数目为16NA
)含有的质子数目为16NA
C.将标准状况下224 mLSO2溶于水制成100 mL溶液,H2SO3、HSO3-、SO32-三者数目之和为0.01NA
D.含63 gHNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A.由Na和Cl形成离子键的过程:![]()
B.常温时,氨气溶于水显碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
C.FeCl3溶液中加入Fe粉,溶液变浅绿:Fe3++Fe=2Fe2+
D.电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铁与盐酸反应:Fe+2H+=Fe3++H2↑
B.氧化镁与稀硫酸反应:O2-+2H+=H2O
C.硫酸铜与氢氧化钡溶液反应:Ba2++SO![]() = BaSO4↓
= BaSO4↓
D.氯气通入氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )

A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镁享有“国防金属”的美誉,目前世界上百分之六十的镁是从海水中提取的,主要反应为:MgCl2+Ca(OH) 2=Mg(OH) 2↓+CaCl2。若往200mL浓缩海水中加入0.37g Ca(OH)2使Mg2+沉淀完全,请计算:
(1)生成沉淀的物质的量________。
(2)该浓缩海水中Mg2+的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
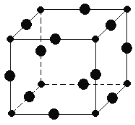
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第________周期________族。
(2)C、N、O三种元素的第一电离能由大到小的顺序为________________。
(3)Cu+的电子排布式为________________________,其在酸性溶液中不稳定,可发生歧化反应生成Cu 2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O________________________________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中H﹣C﹣O的键角________乙醇分子中的H﹣C﹣O的键角(填“大于”、“等于”或“小于”)。
(5)[Cu(H2O)4]2+中的两个H2O被Cl-取代有两种不同的结构,则[Cu(H2O)4]2+的结构为________形。
(6)Cu3N的晶胞结构如图,N3﹣的配位数为________,Cu+半径为a pm,N3﹣半径为bpm,Cu3N的密度________________g/cm3。(阿伏加德罗为常数用NA表示)(1pm=10﹣10 cm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“吸收—电解”循环法脱除烟气中的SO2,可减少对大气的污染。室温下,电解液K再生的装置如图所示,其中电解液的pH随![]() 变化的关系见下表,下列对此判断正确的是
变化的关系见下表,下列对此判断正确的是
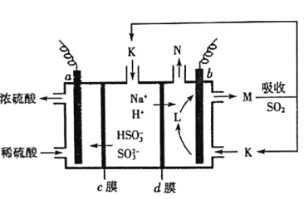
电解液 | n(SO32-):n(HSO3-) | pH |
K | 9:91 | 6.2 |
L | 1:1 | 7.2 |
M | 91:9 | 8.2 |
A.当电解液呈中性时溶液中:![]()
B.再生液M吸收SO2主反应的离子方程式为:![]()
C.HSO3-在b极发生的电极反应式为:![]()
D.若产生标准状况下2.24L气体N,则d膜上共通过0.2mol阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com