
| A. | S2-的结构示意图: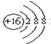 | B. | 氯气的电子式:Cl:Cl | ||
| C. | 氧-18的原子符号:${\;}_{8}^{18}$O | D. | CO2分子的结构式:O=C=O |
分析 A.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
B.氯气的电子式中漏掉了3对孤对电子;
C.元素符号的左上角为质量数、左下角为质子数;
D.二氧化碳分子中含有两个碳氧双键,用短线代替所有共用电子对即为结构式.
解答 解:A.硫离子的核电荷数为16,最外层有8个电子,其结构示意图为 ,故A正确;
,故A正确;
B.氯气分子中存在1个氯氯共用电子对,氯气正确的电子式为 ,故B错误;
,故B错误;
C.氧元素的质量数为8,氧-18的原子符号为${\;}_{8}^{18}$O,故C正确;
D.二氧化碳分子中含有两个碳氧双键,其结构式为O=C=O,故D正确;
故选B.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握电子式、离子结构示意图、结构式、元素符号等化学用语的概念及书写原则,试题培养了学生规范答题的能力.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
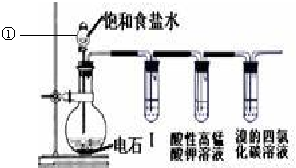
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
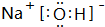 或
或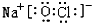 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 滴加少量的CuSO4溶液 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②④⑥ | C. | ③⑤⑥⑦ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com