
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
【答案】D
【解析】
设含铁、氧两种元素的样品A化学式为FexOy,高温时与足量的CO充分反应,FexOy+yCO![]() xFe+yCO2,生成的气体被足量澄清石灰水吸收,CO2+ Ca(OH)2=CaCO3↓+H2O,测得沉淀的质量与原样品A质量相等设为mg,依据化学方程式定量关系列式计算分析判断组成。
xFe+yCO2,生成的气体被足量澄清石灰水吸收,CO2+ Ca(OH)2=CaCO3↓+H2O,测得沉淀的质量与原样品A质量相等设为mg,依据化学方程式定量关系列式计算分析判断组成。
设含铁、氧两种元素的样品A化学式为FexOy,高温时与足量的CO充分反应,FexOy+yCO![]() xFe+yCO2,生成的气体被足量澄清石灰水吸收,CO2+Ca(OH)2=CaCO3↓+H2O,测得沉淀的质量与原样品A质量相等设为m g,
xFe+yCO2,生成的气体被足量澄清石灰水吸收,CO2+Ca(OH)2=CaCO3↓+H2O,测得沉淀的质量与原样品A质量相等设为m g,
FexOy+yCO![]() xFe+yCO2,CO2+Ca(OH)2===CaCO3↓+H2O,
xFe+yCO2,CO2+Ca(OH)2===CaCO3↓+H2O,
得到FexOy ~ yCaCO3
56x+16y 100y
m g m g
56x+16y=100y
x∶y=3∶2,化学式为Fe3O2,则A中一定含Fe,故答案选D。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】分类是学习的一种重要方法,“价一类”二维图对学习化学知识具有重要的指导意义。物质的化学反应常与外界条件密切相关。回答下列问题:
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。
![]()
①若E为红棕色气体,则该气体的收集方法为___;X分子含有10个电子,则气体X水溶液中离子有___。
②若Y为淡黄色固体单质,写出Z→E的化学反应方程式___。
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是___;若足量的MnO2与100mL12mol·L-1的浓盐酸反应,生成Cl2的物质的量___0.3mol(填:“大于”、“等于”、“小于”)。
②足量的锌与浓硫酸反应,反应开始时的化学方程式为___;反应快结束时的离子反应方程式为___。
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(STP),则参加反应的硝酸的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷高温裂解的产物有甲烷、乙烷、乙烯、丙烯 4 种气体,当丁烷完全分解时,所得裂解气的平均式量为 ( )
A.58B.43.5C.29D.14.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列10种有机物
①CH4 ②CH3—C![]() CH ③
CH ③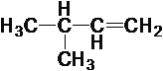 ④
④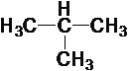 ⑤
⑤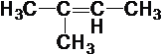 ⑥
⑥ ⑦
⑦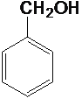 ⑧
⑧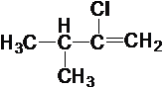 ⑨
⑨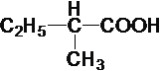 ⑩C8H18
⑩C8H18
请回答(填序号):
(1)属于炔烃的是____,属于醇类的是____。
(2)互为同系物的是____,互为同分异构体的是____。
(3)在有机物分子中,若某个碳原子上连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。则上述有机物中含有手性碳原子的是____,本身没有手性碳原子,但通过与氢气发生加成反应,得到的有机物含有手性碳原子的是___。
(4)上述烷烃中一定不能由烯烃加成得到的是___,若⑩也不能由烯烃加成得到,则⑩的结构简式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,溶液中CN-、HCN物质的量分数(δ)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。溶液的pH变化曲线如图乙所示。下列溶液中的关系正确的是
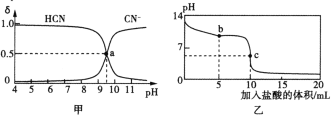
A.图甲中pH=7的溶液:c(Cl-)<c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol·L-1
C.图乙中b点的溶液:c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应与能量的说法正确的是
A.Zn(s)+CuSO4(aq)![]() ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
B.CaCO3(s)![]() CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
C.HCl(g)![]()
![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
D.H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
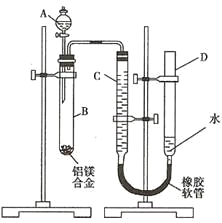
(1)A中试剂为_______________________。
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是_____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤、洗涤、干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂;
⑤检查气密性。上述操作的顺序是______________(填序号);记录C的液面位置时,除视线平视外,还应____________________。
(4)B中发生反应的化学方程式为_________________________________________。
(5)若实验用铝镁合金的质量为a g ,测得氢气体积为b mL(已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将____________(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硫酸钠(Na2S2O8)也叫高硫酸钠、过二硫酸钠,是白色晶状粉末,易溶于水,加热至65℃就会发生分解,用作漂白剂、氧化剂、乳液聚合促进剂。某化学小组对Na2S2O8制备和性质进行探究。
I.实验室制备Na2S2O8
(查阅资料)工业制备过硫酸钠的反应原理:
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
设计如图实验装置:
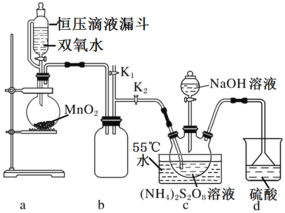
(1)恒压滴液漏斗的优点是___。
(2)装置a中反应产生的气体需要持续通入装置c的目的是___;装置b、d的作用分别是___、___。
(3)反应完毕,将三颈圆底烧瓶中的溶液减压浓缩、结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是___。
II.探究Na2S2O8的性质
(1)酸性过硫酸钠溶液,在Ag+催化作用下可以把Mn2+氧化为MnO4-,该方法可用于检验Mn2+,所得溶液除去Ag+后加入BaCl2溶液可以产生白色沉淀。
①用酸性Na2S2O8溶液检验Mn2+时的实验现象为___。
②该反应的离子方程式为____。
(2)过硫酸钠溶液与铜反应只生成两种盐且反应先慢后快,某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用,设计实验方案检验该推测是否正确___。(供选择试剂:Cu、Na2S2O8溶液、Na2SO4溶液、CuSO4溶液、Cu(NO3)2溶液、CuCl2溶液、蒸馏水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com