
(8分)向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
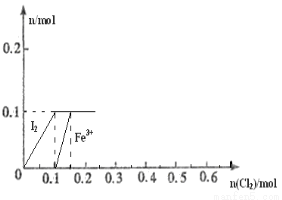
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为___________>____________>____________。
(2)当n(Cl2)=0.12mol时,溶液中的离子主要为__________,从开始通入Cl2到n(Cl2)=0.15mol时的总反应的化学方程式为_____________________________________。
(3)当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为_________
(8分)
(1) I-、Fe2+、I2 (2分) (2) Fe2+、Fe3+、Cl- (2分), 2FeI2+3Cl2=2I2+2FeCl3(2分)。
(3)8.96L(无单位扣1分)(2分)。
【解析】
试题分析:(1)向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,在氧化还原反应中还原性越强的微粒越溶液失电子,由此说明I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为I-、Fe2+、I2。
(2)根据图象,结合反应Cl2+FeI2=FeCl2+I2 知,当通入0.1molCl2时碘离子完全被氧化生成碘单质,碘化亚铁的物质的量是0.1mol;向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,所以当通入Cl2到n(Cl2)=0.12mol时,氯气和亚铁离子反应生成铁离子,2Fe2++Cl2=2Fe3++2Cl-,通入氯气的物质的量是0.02mol时,有0.04mol亚铁离子被氧化,还剩0.06mol亚铁离子,所以溶液中存在的离子是Fe2+、Fe3+、Cl-;到n(Cl2)=0.15mol时,FeI2被Cl2完全氧化,所以离子方程式为:2FeI2+3Cl2=2I2+2FeCl3。
(3)但碘离子转化为碘酸根离子时,亚铁离子完全转化为铁离子,设碘酸根的物质的量是x,则氯离子的物质的量是8x,根据氧化还原反应中得失电子数相等得x×6+(0.2-x)×1+0.1×1=8x×1,x=0.1,所以溶液中碘酸根的物质的量是0.1mol,氯离子的物质的量是0.8mol,根据Cl2~2Cl-知,氯气的物质的量是0.4mol,氯气的体积=0.4mol×22.4L/mol=8.96L。
考点:本题考查氧化还原反应、离子反应、离子方程式的书写、化学计算。


科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.50 mL
查看答案和解析>>
科目:高中化学 来源:2015届浙江省慈溪市、余姚市高三上学期期中联考化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是
A.聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物
B.煤经过气化和液化两个物理变化,可变为清洁能源
C.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
D.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列各离子方程书写正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++ ===BaSO4↓+H2O
===BaSO4↓+H2O
B.将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
C.在FeI2溶液中通入少量的氯气:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
D.Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.Fe(OH)3、FeCl2均可由化合反应制得
B.配制1L0.1mol/LNa2CO3溶液,需称取Na2CO3·H2O的质量为10.6g
C.用澄清石灰水可鉴别CO2和SO2
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I。下列对溶液I中溶质分析正确的是
A. 已知溶液I中溶质的种类和a值,一定能求出V
B.已知V和a的具体数值可以确定溶液I的溶质
C.向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克。由W
和V的值可确定溶液I的溶质
D.溶液I中含有溶质的组合可能有3种
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e → SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e → 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
A.NaClO B.NaClO4 C.HClO D.ClO2
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:实验题
(共12分)
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:

(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是
□ + □ClO3— + □ = □MnO2↓ + □Cl2↑ + □ 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、 、 。
已知蒸发得到的固体中含有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)用浓硫酸来配制本实验需要的稀硫酸,进行如下操作,其中会使所配溶液浓度偏高的是
A用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中
B定容时仰视
C用量筒量取浓硫酸时,读数时仰视
D容量瓶中有水,未进行干燥
(5)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
某一有机物A可发生如下反应:已知C为羧酸,且C、E均不发生银镜反应,则A的可能结构有

A.1种 B.2种
C.3种 D.4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com