
��֪����Cl2ͨ������KOH��Һ�������п�����KC1��KClO��KC1O3����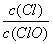 ��ֵ���¶ȸߵ��йء���n(KOH)=amolʱ�������й�˵���������
��ֵ���¶ȸߵ��йء���n(KOH)=amolʱ�������й�˵���������
A����ij�¶��£���Ӧ��c(Cl-):c(ClO-)��11������Һ��c(ClO-):c(ClO3-)��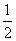
B���μӷ�Ӧ�����������ʵ�������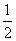 amol
amol
C���ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���n�ķ�Χ��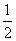 amol��n��
amol��n��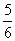 amol
amol
D���ı��¶ȣ�������KC1O3��������۲���Ϊ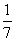 amol
amol
��֪ʶ�㡿������ԭ��Ӧ ���� A1 B3
���𰸽�����D��������n(Cl��)��11 mol����n(ClO��) ��1 mol������11mol Cl�����õ�����11mol������1mol ClO����ʧȥ����1mol�����ݵ����غ�����ClO3-Ϊ��11-1����5��2 mol����A����ȷ���ɷ�Ӧ����KCl��KClO��KClO3�Ļ�ѧʽ������Ԫ������Ԫ�����ʵ���֮�Ⱦ�Ϊ1��1����n(Cl2)��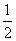 n(Cl)��
n(Cl)��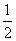 n(KOH)��
n(KOH)��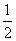 amol��B����ȷ���ı��¶ȣ�����Ӧ��ֻ����KCl��KClO��ת�Ƶ���
amol��B����ȷ���ı��¶ȣ�����Ӧ��ֻ����KCl��KClO��ת�Ƶ���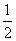 amol������Ӧ��ֻ����KCl��KClO3����ת�Ƶ���
amol������Ӧ��ֻ����KCl��KClO3����ת�Ƶ���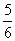 amol��C����ȷ���ı��¶ȣ�����Ӧ��ֻ����KCl��KClO3�����ݵ����غ㣬�ɲ���KClO3(������۲���)1/6amol��D�����
amol��C����ȷ���ı��¶ȣ�����Ӧ��ֻ����KCl��KClO3�����ݵ����غ㣬�ɲ���KClO3(������۲���)1/6amol��D�����
��˼·�㲦���漰��Χ�ļ�����ļ��������ɸ��ݼ������籾���C��D��غ㷨������ԭ��Ӧ�����еij��÷�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��£��Կ��淴Ӧ2X(g) + Y(g) 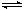 3Z(g) + W(s) ��H>0
3Z(g) + W(s) ��H>0
��������ȷ����
A����������W���淴Ӧ��������ƽ�������ƶ�
B������ѹǿ������Ӧ���������淴Ӧ���ʼ�С
C���¶ȡ�������䣬����He������ѹǿ����Ӧ���ʻ�ӿ�
D�������¶ȣ���������ƽ����Է���������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
MnO2��������Һ�о���ǿ�����ԣ��ɱ���ԭΪMn2����������H2O2�ķֽ�������õĴ�Ч����ij��ȤС��ͨ��ʵ���о�MnO2�����ʡ�
(1)��С�����������4����������֤MnO2�������ԣ����е���________��
A����MnO2������뵽FeSO4��Һ�У��ټ���KSCN��Һ���۲���Һ�Ƿ���
B����MnO2������뵽FeCl3��Һ�У��ټ���KSCN��Һ���۲���Һ�Ƿ���
C����MnO2������뵽Na2SO3��Һ�У��ټ���BaCl2��Һ���۲��Ƿ��а�ɫ��������
D����MnO2������뵽ϡ�����У��۲��Ƿ��л���ɫ��������
(2)��С��Ϊ�о��ڲ�ͬ����Ե���Һ��MnO2�������������� �ǿ���KI��Һ��Ũ�Ⱥ�MnO2�����������ͬ���㶨ʵ���¶���298 K��������¶Ա�ʵ�顣
�ǿ���KI��Һ��Ũ�Ⱥ�MnO2�����������ͬ���㶨ʵ���¶���298 K��������¶Ա�ʵ�顣
| ʵ�� | ����[ | ���� |
| A | 1��0.2 mol/L NaOH��Һ | ����ɫ |
| B | 1��ˮ | ������dz�غ�ɫ |
| C | 1��0.1 mol/L���� | Ѹ�ٱ��غ�ɫ |
��С��������Ա�ʵ���У����Եó��Ľ�����____________________________
__________________________________________________��
д�������������£�MnO2����I�������ӷ���ʽ_____________________________
__________________________________________________��
(3)Ϊ��̽��MnO2�Ĵ�Ч������Ҫ��30%��H2O2��Һ(�ܶȽ���Ϊ1 g/cm3)����Ũ��ԼΪ3%��H2O2��Һ(�ܶȽ���Ϊ1 g/cm3)100 mL�������Ʒ����ǣ�����Ͳ��ȡ________mL 30% H2O2��Һ����________(����������)�У��ټ���һ������ˮ��������ȡ�
(4)��ʵ��ʱ��ijͬѧ��1��KI��Һ����뵽������5 mL 3%��H2O2��Һ�У����ֲ����˴������ݡ���С����ĵ�KI��H2O2�ɷ������·�Ӧ��2KI��H2O2===2KOH��I2����Ϊ�п����Ƿ�Ӧ����I2���˴�H2O2�ֽ�����á������һ����ʵ��֤���ü����Ƿ���ȷ________��
(5)ʵ�����ö������̺�Ũ���Ṳ����ȡ������������������Ϊ�÷�Ӧ�ķ�Ӧ��������________(�����)��
(6)�������̿����������ɵ�أ�����ܷ�ӦΪ��Zn��2MnO2��2NH ===Zn2����Mn2O3��2NH3��H2O�����������ĵ缫��ӦʽΪ________________________________________��
===Zn2����Mn2O3��2NH3��H2O�����������ĵ缫��ӦʽΪ________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
SiCl4��������Ϊ��ɫҺ�壬�ӷ�����ǿ�ҵĴ̼��ԡ���SiCl4��ת��ΪSiHCl3���پ�������ԭ���ɸߴ��衣һ�������£���20L�����ܱ������з���SiCl4ת��ΪSiHCl3 �ķ�Ӧ��3SiCl4(g)��2H2(g)��Si(s) 4SiHCl3(g)����H��Q kJ·mol��1��2 min��ﵽƽ�⣬H2��SiHCl3�����ʵ���Ũ�ȷֱ�Ϊ0.1 mol·L��1��0.2 mol·L��1��
4SiHCl3(g)����H��Q kJ·mol��1��2 min��ﵽƽ�⣬H2��SiHCl3�����ʵ���Ũ�ȷֱ�Ϊ0.1 mol·L��1��0.2 mol·L��1��
��1���ӷ�Ӧ��ʼ��ƽ�⣬v(SiCl4)�� ��
��2���÷�Ӧ��ƽ�ⳣ������ʽΪK�� ���¶����ߣ�Kֵ������Q 0(�����������������)��
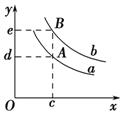 ��3����ƽ������������г�������ʼʱ������SiCl4��H2(����Si����)������Ӧ�ٴδﵽƽ��ʱ����ԭƽ����Ƚϣ�H2����������� (���������С�����䡱)��
��3����ƽ������������г�������ʼʱ������SiCl4��H2(����Si����)������Ӧ�ٴδﵽƽ��ʱ����ԭƽ����Ƚϣ�H2����������� (���������С�����䡱)��
��4��ԭ�����У�ͨ��H2�����(��״����)Ϊ ��
��5��ƽ��������������Ϊ10 L���ٴδﵽƽ��ʱ��
H2�����ʵ���Ũ�ȷ�ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
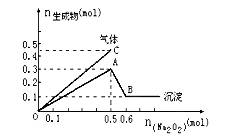
��һ������Mg2+��NH4+��Al3+�����Һ�м���Na2O2���������ɳ�������������������꣩�Ĺ�ϵ��ͼ��ʾ������Һ��Mg2+��NH4+��Al3+�������ӵ����ʵ���֮��Ϊ�� ����
A.1��1��2 B. 2��2��1
C. 1��2��2 D.9��2��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ����٤����������ֵ������˵����ȷ����
A. 0.1 mol·L-1��NaF��Һ������F-����ĿС��0.1NA
B. ��״���£�2.24L�Ҵ��к��е�C—H����ĿΪ0.5NA
C. 0.1 molNa��ȫ����������Na2O2��ת�Ƶ��ӵ���ĿΪ0.1NA
D. 0.1 molO3�к���ԭ����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NA���������ӵ�����������������ȷ����
A��1 mol Cl2�ڷ�Ӧ�еõ���������һ��Ϊ2NA
B��1 mol O2�ڷ�Ӧ�еõ�������һ��Ϊ4 NA
C��1 mo1 Na2O2������H2O��Ӧ��ת����2 NA ������
D����2KClO3+4HC1(Ũ)= =2KCl+2C1O2��+C12��+2H2O�У��������������������ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ܱ������г���N2��H2���ϳ�NH3����2��ĩ��ã�v (H2) =0.45 mol / (L��s)����2��ĩNH3��Ũ��Ϊ�� ��
A. 0.9 mol / L B. 0.45 mol / L C. 0.6 mol / L D. 0.55 mol / L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£�10mL0.40mol/L H2O2��Һ�������ֽ⡣��ͬʱ�̲ⶨ����
O2�������������Ϊ��״�������±���
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A��0~6min��ƽ����Ӧ���ʣ�v(H2O2)��3.3��10-2mol/(L·min)
B��6~10min��ƽ����Ӧ���ʣ�v(H2O2)<3.3��10-2mol/(L·min)
C����Ӧ��6minʱ��c(H2O2)=0.3mol/L
D����Ӧ��6minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com