
| A. | CO2+H2O?H2CO3 | B. | OH-+HS-?S2-+H2O | ||
| C. | HS-+H2O?H3O++S2- | D. | S2-+H2?HS-+OH- |
分析 根据盐类水解的定义:盐电离出的弱酸或弱碱离子与水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应,以此来解答.
解答 解:A.CO2+H2O?H2CO3是CO2与水反应生成碳酸,不属于水解反应,故A错误;
B.HS-+H2O?H3O++S2-是HS-的电离方程式,不属于水解反应,故B错误;
C.HS-+H2O?H3O++S2-是HS-与碱反应的离子方程式,不是水解方程式,故C错误;
D.S2-+H2?HS-+OH-是S2-与水电离出来的氢离子结合生成HS-,属于水解反应,故D正确;
故选D.
点评 本题考查盐类水解原理、水解离子方程式的分析判断,注意电离方程式的理解应用,要特别注意电离方程式与水解方程式的辨别,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
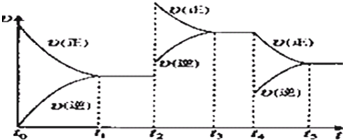
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
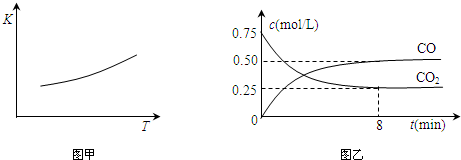
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+H2O(g)═CO(g)+H2(g)不能自发进行,则该反应的△H>0 | |
| B. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H>0,△S<0 | |
| C. | 放热的自发过程,一定是熵增加的过程 | |
| D. | 液态水可自发挥发成水蒸气的过程是熵减的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
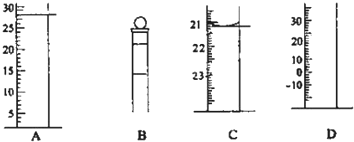
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
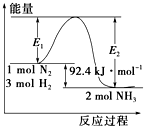 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下4.48L的二氧化碳 | |
| B. | 3.2g氧气(氧气的摩尔质量为32g.mol-1) | |
| C. | 含0.4NA个分子的氢气 | |
| D. | 0.5mol氮气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (3)(4) | C. | (1)(3) | D. | (2)(4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com