
【题目】每年的6月26日是国际禁毒日.以下是四种毒品的结构简式,下列有关说法正确的是( ) 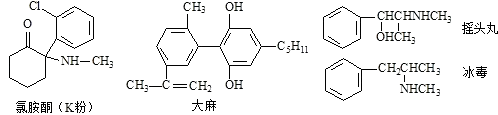
A.四种毒品中都含有苯环,都属于芳香烃
B.摇头丸经消去、加成反应可制得冰毒
C.1mol大麻与溴水反应最多消耗4mol Br2
D.氯胺酮分子中环上所有碳原子可能共平面
【答案】B
【解析】解:A.均含至少3种元素,而烃只含C、H元素,则均不属于芳香烃,故A错误;
B.摇头丸制得冰毒,先发生﹣OH的消去反应,再与氢气加成,反应类型分别为消去反应、加成反应,故B正确;
C.大麻中酚﹣OH的2个邻位与双键与溴水反应,则1mol大麻与溴水反应最多消耗3mol Br2 , 故C错误;
D.氯胺酮分子中,苯环上C原子共面,但环己酮结构中含5个四面体构型的C原子,则环己酮结构中C原子不可能共面,故D错误;
故选B.
【考点精析】通过灵活运用有机物的结构和性质,掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解即可以解答此题.


科目:高中化学 来源: 题型:
【题目】以氯乙烷为原料制备1,2﹣二溴乙烷,下列方案中合理的是( )
A.CH3CH2Cl ![]() CH3CH2OH
CH3CH2OH ![]() CH2=CH2
CH2=CH2 ![]() CH2BrCH2Br
CH2BrCH2Br
B.CH3CH2Cl ![]() CH2BrCH2Br
CH2BrCH2Br
C.CH3CH2Cl ![]() CH2=CH2
CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH2BrCH2Br
CH2BrCH2Br
D.CH3CH2Cl ![]() CH2=CH2
CH2=CH2 ![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1) 已知:CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=____________kJ·mol-1
(2)一定条件下,在容积为2L的密闭容器中充入1mol CO与2 mol H2合成甲醇 平衡转化率与温度、压强的关系如右图所示。

①在2 min时测得容器内甲醇的浓度为0.25 mol·L-1,则0-2 min内CO的平均反应速率为____mol·L-1·min-1,H2的转化率为____。
②由图判断P1_______P2(填“>” 、“<” 或“=” ),理由是____________________________________
③该甲醇合成反应在A点的平衡常数K=____
④下列措施中能够同时满足增大反应速率和提高CO转化率的是____。(填写相 应字母)
A、使用高效催化剂 b、降低反应温度 c、增大体系压强
D、不断将CH3OH从反应混合物中分离出来
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:
该小组设计的原电池原理如右图所示。

该电池中右侧为________极,写出该电池负极的电极反应式 ____。
(4)电解法:
该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右图所示。

写出开始电解时阳极的电极反应式____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________个B相连,As的杂化形式为_______________;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________(填晶体类型)。
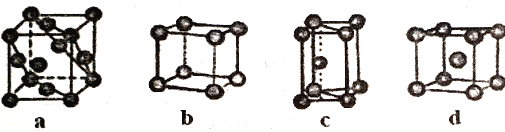
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________(填字母)。
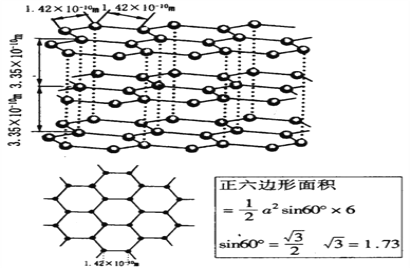
(6)石墨晶体的结构如下图,石墨的密度为________________________________(只列式不化简不计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.按系统命名法,化合物 ![]() (键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
(键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B.环己烯与化合物  (键线式结构)互为同系物
(键线式结构)互为同系物
C.分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若将所有可能得到的醇和酸重新酯化,可形成的酯共有16种
D.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯璜化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 |
②易分解:SO2Cl2 SO2↑+Cl2↑ |
H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的化学方程式为SO2(g)+Cl2(g) ![]() SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器B的作用是_____________________。
(2)若无装置乙硫酰氯会发生水解,则硫酰氯水解反应的化学方程式为________________。
(3)写出丁装置中发生反应的化学反应方程式并标出电子的转移__________________。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为________________________,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___________________。
(6)工业上处理SO2废气的方法很多,例如可以用Fe2(SO4)3酸性溶液处理,其工艺流程如下溶液②转化为溶液③发生反应的离子方程式为__________________________ ;
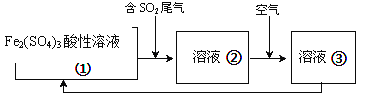
有的工厂用电解法处理含有SO2的尾气,其装置如下图所示(电极材料均为惰性电极)。下列说法不正确的是_______
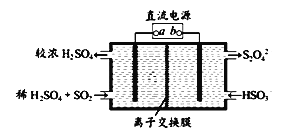
A.电极a连接的是电源的正极
B.若电路中转移0.03mole-,则离子交换膜左侧溶液中增加0.03mol离子
C.图中的离子交换膜是阳离子交换膜
D.阴极的电极反应式为2HSO3-+2e-+2H+==S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( ) 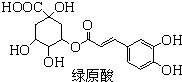
A.奎尼酸分子式为C9H8O4
B.1mol奎尼酸与NaOH溶液反应,最多消耗5mol NaOH,1mol绿原酸与Br2水反应,最多消耗6mol Br2
C.绿原酸能发生取代、加成、消去和还原反应
D.咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如图,其中B为可使带火星木条复燃的气态单质、D为黄绿色气态单质。
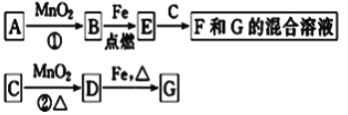
请回答下列问题:
(1)物质B和D分别为__________________________
(2)MnO2在反应①和②中的作用分别是______________________________
(3)新配制的F溶液应加入_____以防止其转化为G.检验G溶液中阳离子的常用试剂是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白原理相同
②向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2=2 Fe3++2Br2+6Cl-
③电解精炼铜时,以粗铜作阴极,纯铜作阳极
④钢铁的吸氧腐蚀负极电极反应式 :Fe-3e-=Fe3+
⑤碳酸氢根离子的电离方程式可表示为: HCO3- + H2O![]() H3O++ CO32-
H3O++ CO32-
⑥SiO2 虽是酸性氧化物,但其不溶于水,因此不能与NaOH溶液反应
⑦ CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在
⑧浓硫酸具有脱水性,所以可以做干燥剂
A.②④⑧ B.②⑤ C.③④⑥ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com