
【题目】在元素周期表中,分别与周期数、主族序数相同的一组是()
①质子数 ②核电荷数 ③电子层数 ④原子序数 ⑤最外层电子数
A.③⑤B.②③C.③④D.①⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】随着碱金属元素原子序数的增大,下列递变规律错误的是( )
A.原子半径逐渐增大
B.最高价氧化物对应水化物的碱性逐渐增强
C.单质的熔、沸点逐渐升高
D.单质的还原性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是

A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应
B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙可能是铜和稀硝酸
C. 若甲为硫磺燃烧产物,丁为水,则戊不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的沸点高于H2S是因为________________;H2O分子比H2S分子稳定是因为__________________。
(2)Al和铁红发生铝热反应的化学方程式_________________,该反应的用途是_________________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
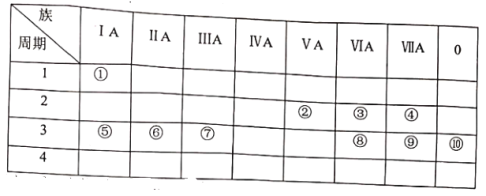
试用合适的化学用语回答下列问题:
(1)请画出元素④简单阴离子的结构示意图:____________。
(2) ③⑤⑧的原子半径由小到大的顺序为__________(填元素符号)。
(3)⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____ > _____(填化学式)。
(4) ③⑤两种元素的原子按1:1组成的常见化合物的电子式 为_______。
(5)写出⑦的单质与⑤的最高价氧化物对应水化物溶液反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在现代有机化工生产中,通过天然气裂解所得某种主要成分,已成为制造合成纤维、人造橡胶、塑料的基石.其中相关物质间的转化关系如下图所示(C、G是两种常见的塑料,E的结构简式为![]() )
)
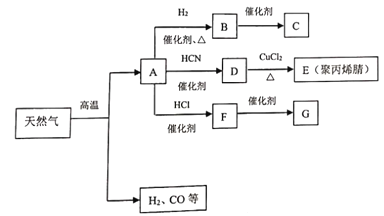
请回答下列问题:
(1)写出B的电子式_________。
(2)分别写出下列反应的化学方程式A→D______;F→G______。
II.为测定某有机化合物X的化学式. 进行如下实验;将0.15mo1有机物B和0.45mol O2在密闭容器中完全燃烧后的产物为CO2、CO、H2O(气),产物经过浓H2SO4后.质量增加8.1g,再通过灼热的氧化铜充分反应后,质量减轻2.4g,最后气体再通过碱石灰被完全吸收,质量增加19.8g. 试通过计算确定该有机物X的化学式(写出计算过程) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O![]() +O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. O2和S2O![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子数为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com