
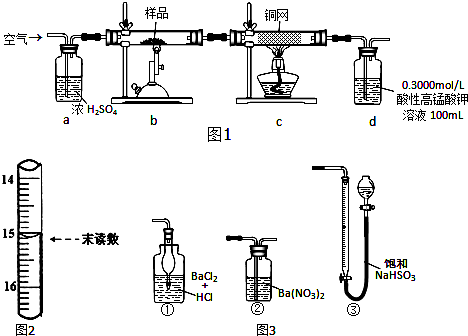
分析 (1)称取研细的样品4.000g,由质量的精确度可知不能用托盘天平来称量;
(2)装置a为除去空气中的水蒸气避免影响测定结果,同时可以观察气体流速控制反应进行的速率;
(3)继续通入空气目的是把装置中的二氧化硫气体全部赶出完全吸收;
(4)草酸被高锰酸钾溶液氧化为二氧化碳,高锰酸钾被还原为锰离子;依据滴定管的结构,利用开始和结束的体积差值计算得到消耗草酸溶液的体积;
(5)依据灼烧反应和滴定反应的定量关系计算硫化亚铁的质量分数;
(6)装置d是用于吸收并测定产物中二氧化硫的含量,根据二氧化硫的化学性质进行判断.
解答 解:(1)称取研细的样品4.000g,由质量的精确度可知不能用托盘天平来称量,托盘天平的精确度为0.1g,
故答案为:不能;
(2)分析装置图可知为准确测定样品中FeS2样品的纯度,利用空气中的氧气氧化硫化亚铁反应生成二氧化硫被高锰酸钾溶液吸收后,用草酸滴定计算,过程中空气中的水蒸气会干扰测定,需要通过浓硫酸除去,所以装置 a的作用是干燥或除去水蒸气,同时根据气泡冒出观察气体流速,
故答案为:干燥空气,观察气体流速;
(3)继续通入空气目的是把装置中的二氧化硫气体全部赶出完全吸收,减少误差,
故答案为:促进装置中的二氧化硫气体全部吸收;
(4)草酸被高锰酸钾溶液氧化为二氧化碳,高锰酸钾被还原为锰离子,反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,依据滴定管的结构,利用开始和结束的体积差值计算得到消耗草酸溶液的体积为:15.10mL-0.10mL=15.00mL,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(5)依据反应的离子方程式计算与二氧化硫反应的高锰酸钾物质的量,得到二氧化硫的物质的量,结合元素守恒计算硫化亚铁的质量分数,结合反应的离子方程式计算得到:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,100mL溶液中剩余高锰酸钾物质的量为:$\frac{2}{5}$×0.01500L×0.1000mol/L×10=0.006mol,与二氧化硫反应的高锰酸钾物质的量为:0.3000mol/L×0.1000L-0.006mol=0.024mol,结合反应5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4可得:
5FeS2~10SO2~4KMnO4
5 4
n(FeS2) 0.024mol
n(FeS2)=0.03mol
样品中FeS2的纯度为:$\frac{0.03mol×120g/mol}{4.000g}$×100%=90%,
故答案为:90%;
(6)图3中,只有②能够与二氧化硫反应生成硫酸钡沉淀,可以替代装置d;而①无法吸收二氧化硫,③中空气不溶于水,干扰了二氧化硫的测定,
故答案为:②.
点评 本题考查了物质组成的实验探究方法分析,题目难度中等,理解反应原理和滴定实验的计算是解题关键,试题充分考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②①③ | C. | ③①② | D. | ③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
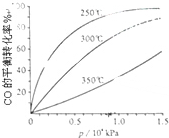 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com