
| A.铁单质只具有还原性,其阳离子只具有氧化性 |
| B.常温下,单质铁与浓硫酸不反应 |
| C.铁元素属于过渡元素,其原子序数为26 |
| D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快 |
科目:高中化学 来源:不详 题型:单选题
| A.0.8g | B.0.8ag | C.(a—1.6)g | D.(a—0.8)g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
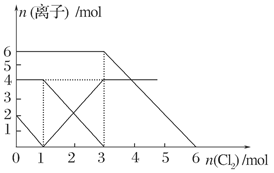
| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+) ∶n(I-) ∶n(Br-)=2 ∶1 ∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
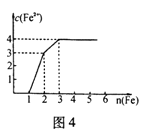
| A.1:1:1 | B.1:3:1 | C.3: 3: 8 | D.1:1:4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
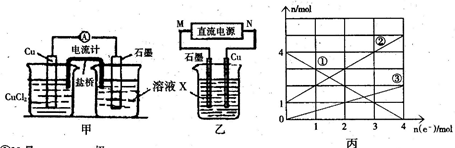
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.14g | B.1.6g | C.2.82g | D.4.36g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3:4 | B.1:l | C.5:6 | D.2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com