
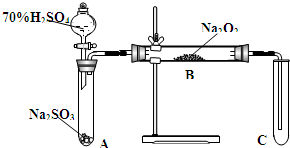
 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.分析 (1)Na2O2与CO2反应生成碳酸钠和氧气;
(2)①装置A是二氧化硫的发生装置,生成的二氧化硫气体中含有水蒸气,AB间需要加一个干燥装置,避免水蒸气的存在与过氧化钠反应影响探究二氧化硫和过氧化钠的反应;
②装置C是验证氧气生成,A中生成的二氧化硫气体是污染性气体,不能排放到空气中;在BC间加一个吸收装置;
(3)①依据类推可知二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,亚硫酸钠和氧气反应可以生成硫酸钠,据此推断白色固体可能的组成;
②利用亚硫酸钠和盐酸反应生成二氧化硫气体验证亚硫酸根离子的存在,依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在.
解答 解:(1)Na2O2与CO2反应生成碳酸钠和氧气,该反应为2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(2)①装置A是二氧化硫的发生装置,生成的二氧化硫气体中含有水蒸气,AB间需要加一个干燥装置,避免水蒸气的存在影响探究二氧化硫和过氧化钠的反应,
故答案为:产生二氧化硫没有干燥,水蒸气会与Na2O2反应;
②装置C是验证氧气生成,A中生成的二氧化硫气体是污染性气体,不能排放到空气中;所以在BC间加一个吸收装置,用一个盛有氢氧化钠溶液的洗气瓶吸收二氧化硫,
故答案为:NaOH;除去SO2气体,防止污染空气;
(3)①依据类推可知二氧化硫和过氧化钠反应生成亚硫酸钠和氧气,亚硫酸钠和氧气反应可以生成硫酸钠,据此推断白色固体可能的组成为:亚硫酸钠、硫酸钠、亚硫酸钠和硫酸钠的混合物,所以假设3为:白色固体为Na2SO4,
故答案为:白色固体为Na2SO4 ;
②依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在;利用亚硫酸钠和盐酸反应生成二氧化硫气体验证亚硫酸根离子的存在,故答案为:稀盐酸;氯化钡溶液.
点评 本题考查了物质性质的实验设计和实验验证分析判断,题目难度中等,明确二氧化硫、二氧化碳和过氧化钠性质的分析应用是解题关键,试题侧重考查学生的分析、理解能力及知识迁移能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| D. | FeSO4溶液中加入少量Fe粉和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0| c(SO2)/mol•L-1 | c(Cl2)/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| B. | 纤维素→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂→甘油和高级脂肪酸→CO2和H2O(释放能量维持生命活动) | |
| D. | 麦芽糖→葡萄糖→CO2和H2O(释放能量维持生命活动) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z |  |
| A | 含氧酸 | 一元强酸 | HclO4 | |
| B | 易溶碱 | 强碱 | NaOH | |
| C | 盐 | 酸式盐 | NaHCO3 | |
| D | 非电解质 | 氧化物 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com