
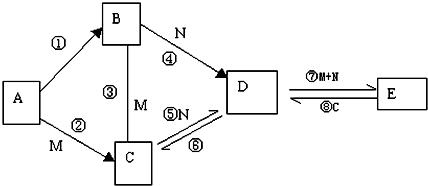
分析 A、B、C、D、E五种物质的焰色反应都呈黄色,说明都含有钠元素,①的条件是点燃,B为淡黄色粉末,则B为Na2O2,所以A为Na,M是一种液体氧化物,则M为H2O,所以C为NaOH,N是气体化合物,B和N能生成D,则N为CO2,D为Na2CO3,与二氧化碳、水反应生成E为NaHCO3,E与氢氧化钠反应生成D,符合各物质的转化关系,据此答题.
解答 解:A、B、C、D、E五种物质的焰色反应都呈黄色,说明都含有钠元素,①的条件是点燃,B为淡黄色粉末,则B为Na2O2,所以A为Na,M是一种液体氧化物,则M为H2O,所以C为NaOH,N是气体化合物,B和N能生成D,则N为CO2,D为Na2CO3,与二氧化碳、水反应生成E为NaHCO3,E与氢氧化钠反应生成D,符合各物质的转化关系,
(1)根据上面的分析可知,A为Na,B为Na2O2,D为Na2CO3,
故答案为:Na;Na2O2;Na2CO3;
(2)反应⑦的离子方程式为CO32-+CO2+H2O=2 HCO3-,反应⑧的离子方程式为HCO3-+OH-=CO32-+H2O,故答案为:CO32-+CO2+H2O=2 HCO3-;HCO3-+OH-=CO32-+H2O.
点评 本题是考查无机物推断、常用化学用语,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
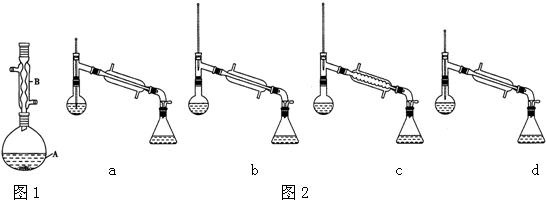
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
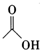 +
+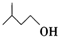 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ 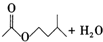
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 mL | B. | 90 mL | C. | 120 mL | D. | 45 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
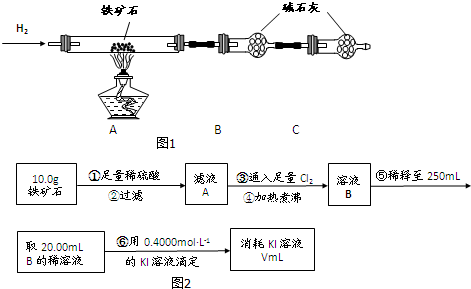
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
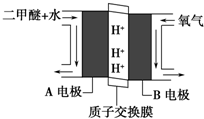 (1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.
(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 1:7 | C. | 2:11 | D. | 16:25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池工作时,正极反应为2SOCl2+4e-═4Cl-+S+SO2 | |
| B. | 锂电极作该电池负极,负极反应为Li-e-═Li+ | |
| C. | 该电池组装时,必须在无水无氧条件下进行 | |
| D. | 该电池工作时,电子通过外电路从正极流向负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com