
| ���� | �� | �� | CO | H2 |
| ȼ����/(kJ��mol��1) | 1 366 | 5 518 | 283 | 286 |



 ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 Fe3+(aq)+3OH-(aq) �� ��H=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) �� ��H=" a" kJ?mol-1 H+(aq)+OH-(aq) ����H=" b" kJ?mol-1
H+(aq)+OH-(aq) ����H=" b" kJ?mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
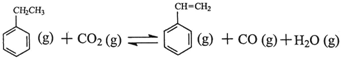 ��H
��H ��H1=��117.6kJ��mol��1
��H1=��117.6kJ��mol��1 CO (g)��H2O (g) ��H2=��41.2kJ��mol��1
CO (g)��H2O (g) ��H2=��41.2kJ��mol��1 ��
��| A������0.5mol/L | B����0.5mol/L |
| C������0.5mol/L | D����ȷ�� |
 ����Ӧ�ﵽƽ��ʱ����ϩ��Ũ��Ϊ �� �����ú�
����Ӧ�ﵽƽ��ʱ����ϩ��Ũ��Ϊ �� �����ú� ��P�ı���ʽ��ʾ����
��P�ı���ʽ��ʾ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| ʵ���� | T(��) | n(N2)/n(H2) | p(MPa) |
| �� | 450 | 1/3 | 1 |
| �� | �� | �� | 10 |
| �� | 480 | �� | 10 |
 2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2H2��+O2��
2H2��+O2�� 2H2��+O2��
2H2��+O2�� 2H2��+O2��
2H2��+O2�� CO+3H2
CO+3H2 CH3OH��g��+H2O��g������H="-49.0" kJ/mol,���CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
CH3OH��g��+H2O��g������H="-49.0" kJ/mol,���CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
 CH3OH��g����ƽ�ⳣ��:
CH3OH��g����ƽ�ⳣ��:| �¶�/�� | 0 | 100 | 200 | 300 | 400 |
| ƽ�ⳣ�� | 667 | 13 | 1.9��1 | 2.4��1 | 1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


 ,��H=__________kJ
,��H=__________kJ ���ú�a��b��c��d��ʽ�ӱ�ʾ����
���ú�a��b��c��d��ʽ�ӱ�ʾ����
 (CO)___________B����淴Ӧ����
(CO)___________B����淴Ӧ���� (NO)���>������<����=������
(NO)���>������<����=������
| A��ƽ��������Ӧ�����ƶ� | B��CO������������� |
| C��ƽ�ⳣ����С | D��һ����̼��Ũ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H2����H1 | B����H2+��H1 | C����H1����H2 | D������H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ĵ�����������ȵ� |
| B����V��20ʱ����Һ�У�c��F������c��Na������0.1mol/L |
| C����V��20ʱ����Һ������Ũ�ȹ�ϵ����Ϊ��c��Na������c��F���� |
| D����V��20ʱ����Һ������Ũ�ȹ�ϵһ��Ϊ��c��Na������c��F������c��OH������c��H���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com