
 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
分析 (1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol、
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol、
③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,根据盖斯定律③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol,据此进行分析;
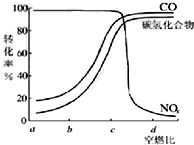
(2)①探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果,必须控制其它条件相同;
②由图象分析,NO和CO的转化率越高,催化效果越好.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol、
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol、
③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,根据盖斯定律③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol,
故答案为:-746.5 kJ/mol;
(2)①探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果,必须控制其它条件相同,即汽车尾气的流速,催化反应的温度相同,
故答案为:催化反应的温度;
②由图象可知,在c点时NO和CO的转化率最高,催化效果最好,
故答案为:c.
点评 本题考查了盖斯定律在热化学方程式计算中的应用方法,图象分析等问题,题目难度中等,注意加强对图象的分析能力的培养.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA | |
| C. | 常温下,1L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| D. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 乳酸分子[CH3-CH(OH)-COOH]中有 1 个手性碳且 1 mol 该分子中有 11 mol σ 键 | |
| C. | PCl5分子中P原子和Cl原子最外层都满足8电子结构 | |
| D. | H-O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨和金刚石完全燃烧,后者放热多 | |
| B. | 金刚石比石墨稳定 | |
| C. | 等量的金刚石储存的能量比石墨高 | |
| D. | 石墨很容易转化为金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 将0.1mol•L-1MgSO4溶液滴入 过量NaOH溶液,再滴加几滴0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落下来 | 铝箔表面有致密Al2O3薄膜,Al2O3且熔点高于Al |
| C | 向新收集的酸雨中滴加硝酸钡溶液 | 产生白色沉淀 | 酸雨中一定含有SO42- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I2互为同位素 | |
| B. | lmol碳酸钾晶体中含阴离子数为等于NA个 | |
| C. | 分子式为C4H8O2的羧酸共有3种 | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com