
由A、B两种粉末组成的混合物,在一定条件能发生如图所示的转化关系.其中B、C均为氧化物,J为黄绿色气体,部分反应产物已略去.
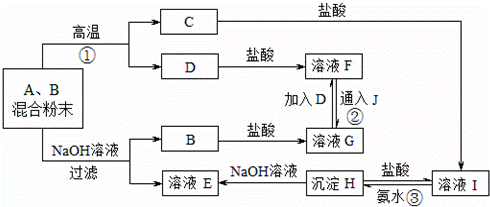
请 回答:
回答:
(1)写出相应物质的化学式:A ,B
(2)写出图中相应转化的离子方程式:反应② 反应③ (3)反应①的主要用途是 (回答一条即可).
(4)以下选项中的试剂可以检验溶液F中的金属阳离子的是 (填字母编号).
a.NaOH溶液 b.KSCN溶液 c.稀硫酸 d.新制氯水与KSCN溶液.
考点: 无机物的推断.
专题: 推断题.
分析: 解题的第一个“突破口”是J在常温下是黄绿色气体,J为Cl2,由A、B两种粉末组成的混合物,在高温下能反应生成CD,且B、C均为氧化物,该反应为铝热反应的特征,则A为Al,B为金属性弱于铝的金属氧化物,又由F、G的转化可知,D为变价金 属,则D为Fe,F为FeCl2,G为FeCl3,则B为Fe2O3,A+B→C+D反应为:Fe2O3+2Al
属,则D为Fe,F为FeCl2,G为FeCl3,则B为Fe2O3,A+B→C+D反应为:Fe2O3+2Al Al2O3+2Fe,C为Al2O3,C→I反应为:Al2O3+6HCl═2AlCl3+3H2O,I为AlCl3,I→H反应为:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl沉淀H为Al(OH)3,H→E反应为:Al(OH)3+NaOH═NaAlO2+2H2O,A、B两种粉末组成的混合物与氢氧化钠溶液作用,发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;B→G发生反应为:Fe2O3+6HCl═2FeCl3+3H2O,D→F反应为:Fe+2HCl═FeCl2+H2↑,F→G反应为:2FeCl2+Cl2=2FeCl3,G→F反应为:Fe+2FeCl3=3FeCl2,以此解答该题.
Al2O3+2Fe,C为Al2O3,C→I反应为:Al2O3+6HCl═2AlCl3+3H2O,I为AlCl3,I→H反应为:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl沉淀H为Al(OH)3,H→E反应为:Al(OH)3+NaOH═NaAlO2+2H2O,A、B两种粉末组成的混合物与氢氧化钠溶液作用,发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;B→G发生反应为:Fe2O3+6HCl═2FeCl3+3H2O,D→F反应为:Fe+2HCl═FeCl2+H2↑,F→G反应为:2FeCl2+Cl2=2FeCl3,G→F反应为:Fe+2FeCl3=3FeCl2,以此解答该题.
解答: 解:解题的第一个“突破口”是J在常温下是黄绿色气体,J为Cl2,由A、B两种粉末组成的混合物,在高温下能反应生成CD,且B、C均为氧化物,该反应为铝热反应的特征,则A为Al,B为金属性弱于铝的金属氧化物,又由F、G的转化可知,D为变价金属,则D为Fe,F为FeCl2,G为FeCl3,则B为Fe2O3,A+B→C+D反应为:Fe2O3+2Al Al2O3+2Fe,C为Al2O3,C→I反应为:Al2O3+6HCl═2AlCl3+3H2O,I为AlCl3,I→H反应为:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl沉淀H为Al(OH)3,H→E反应为:Al(OH)3+NaOH═NaAlO2+2H2OE为NaAlO2,A、B两种粉末组成的混合物与氢氧化钠溶液作用,发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;B→G发生反应为:Fe2O3+6HCl═2FeCl3+3H2O,D→F反应为:Fe+2HCl═FeCl2+H2↑,F→G反应为:2FeCl2+Cl2=2FeCl3,G→F反应为:Fe+2FeCl3=3FeCl2,
Al2O3+2Fe,C为Al2O3,C→I反应为:Al2O3+6HCl═2AlCl3+3H2O,I为AlCl3,I→H反应为:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl沉淀H为Al(OH)3,H→E反应为:Al(OH)3+NaOH═NaAlO2+2H2OE为NaAlO2,A、B两种粉末组成的混合物与氢氧化钠溶液作用,发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;B→G发生反应为:Fe2O3+6HCl═2FeCl3+3H2O,D→F反应为:Fe+2HCl═FeCl2+H2↑,F→G反应为:2FeCl2+Cl2=2FeCl3,G→F反应为:Fe+2FeCl3=3FeCl2,
推出A为Al,B为Fe2O3,C为Al2O3,D为Fe,E为NaAlO2,F为FeCl2,G为FeCl3,H为Al(OH)3,I为AlCl3,J为Cl2,
(1)由以上分析可知A为Al,B为Fe2O3,
故答案为:Al;Fe2O3;
(2)反应②为F→G2FeCl2+Cl2=2FeCl3,离子反应为:2Fe2++Cl2═2Fe3++2Cl﹣,反应③为I→H:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,离子反应为:Al3++3NH3•H2O═Al (OH)3↓+3NH4+,
故答案为:2Fe2++Cl2═2Fe3++2Cl﹣;Al3++3NH3•H2O═Al (OH)3↓+3NH4+;
(3)反应①为Fe2O3+2Al Al2O3+2Fe,属于铝热反应,其原理是活泼金属在高温下置换出其它金属,重要用途是焊接钢轨或冶炼难熔金属,
Al2O3+2Fe,属于铝热反应,其原理是活泼金属在高温下置换出其它金属,重要用途是焊接钢轨或冶炼难熔金属,
故答案为:焊接钢轨或冶炼难熔金属;
(4)F为FeCl2,
a.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,白色氢氧化亚铁被氧化为红褐色氢氧化铁,说明该溶液中含有Fe2+,故a正确;
b.亚铁离子与硫氰化钾溶液不作用,无法检验,故b错误;
c.稀硫酸与亚铁离子不作用,无法检验,故c错误;
d.Fe2+与KSCN溶液反应无血红色出现,但Fe3+与KSCN反应产生血红色,加新制氯水与KSCN溶液,氯水氧化亚铁离子生成三价铁离子产生血红色,故d正确;
故答案为:ad;
点评: 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意把握信息中的题眼,为解答该题的关键,在平时学习中要多总结,勤反思,熟练掌握物质的特征反应现象、产物颜色、反应变化等知识,构建物质之间转化关系的网络图,这样解答类似题目将很顺手.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
水是生命之源,也是重要的环境要素之一。
(1)观察下图(Ⅰ),若用1 L水来代表地球上的总水量,要比较精确地量取地
球上的淡水量,应选择的仪器是__________。
A.100 mL烧杯 B.50 mL烧杯
C.100 mL量筒 D.50 mL量筒
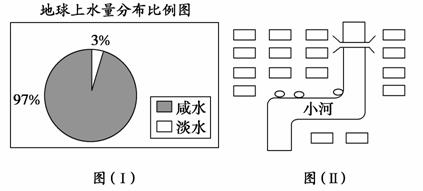
(2)图(Ⅱ)是某居民小区中垃圾收集点(小圈)的布局,它在选址上存在的问题有
________;垃圾收集点选址应考虑的因素包括__________________________
_________________________________________________________________。
(3)有人设想在住宅小区附近建立小型生活垃圾焚烧厂,其流程如图(Ⅲ)。请
将图(Ⅲ)中①②③所要表达的内容填在下面的横线上。
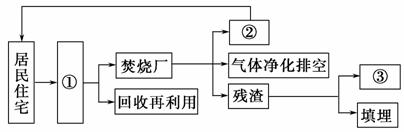
图(Ⅲ)
①______________________________________________________________;
②______________________________________________________________;
③______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释错误的是()
现象 解释或结论
A SO2使酸性高锰酸钾溶液褪色 SO2表现还原性
B 浓硝酸在光照条件下变黄 浓硝酸不稳定,生成有色物质生成且能溶于浓硝酸
C 某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝 该溶液中一定含有NH4+
D 将铜片放入浓硫酸中,无明显实验现象 铜在冷的浓硫酸中发 生钝化
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式表示正确的是()
A. 澄清石灰水中通入过量二氧化碳:OH﹣+CO2═HCO3﹣
B. 铜片跟三氯化铁溶液反应:Fe3++Cu═Cu2++Fe2+
C. 漂白粉溶液中通入少量SO2:Ca2++2ClO﹣+SO2+H2O═CaSO3↓+2HClO
D. Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置设计正确,且能达到目的是()
A. 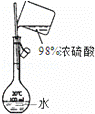
配制稀硫酸溶液
B. 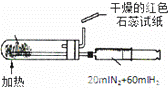
合成氨并检验氨的生成
C. 
碘的CCl4溶液中分离I2并收回CCl4
D. 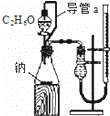
测定乙醇分子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Cl﹣、Fe2+、H2O2、I﹣、SO2均具有还原性,且在酸性溶液中的还原性依次增强.下列各反应不可能发生的是()
A. 2Fe2++Cl2═2Fe3++2Cl﹣
B. 2Fe3+十SO2十2H2O=2Fe2+十SO42﹣十4H+
C. H2O2十H2SO4=SO2↑十O2↑十2H2O
D. SO2十I2十2H2O=H2SO4十2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应最终能生成Fe3+的化合物的是()
①过量Fe与HNO3
②铁丝在硫蒸汽中燃烧
③向FeBr2溶液中通入Cl2
④铁与CuCl2溶液反应
⑤Fe(OH)2露置于空气中.
A. ①②③ B. ①③⑤ C. ③④ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 78 gNa2O2晶体中所含阴阳离子个数均为2NA
B. 1.5 g CH3+中含有的电子数为NA
C. 3.4 g氨气分子中含有0.6NA个N﹣H键
D. 常温下,100 mL1 mol•L﹣1AlCl3溶液中Al3+离子总数等于0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com