
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
分析 A.依据浓硝酸的强氧化性、酸性解答;
B.硝酸中硝酸根离子氧化性强于氢离子氧化性;
C.依据浓硝酸的不稳定性解答;
D.依据硝酸具有酸性,能够与氢氧化钠发生酸碱中和反应.
解答 解:A.浓硝酸具有酸性使紫色石蕊试液变红,浓硝酸具有强的氧化性,具有漂白性,所以溶液褪色,故A正确;
B.硝酸具有强的氧化性,稀硝酸与任何金属反应都不会生成氢气,故B正确;
C.浓硝酸具有不稳定性,见光分解,应保存在棕色瓶中,故C正确;
D.硝酸具有酸性,能够与氢氧化钠发生酸碱中和反应,能使滴有酚酞的氢氧化钠溶液红色褪去,与氧化性无关,故D错误;
故选:D.
点评 本题考查了物质的性质,熟悉硝酸的强氧化性、酸性、不稳定性是解题关键,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | AlC13和NaOH | C. | NaAlO2和H2SO4 | D. | NaHCO3和Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、I-、NO3- | ||
| C. | Fe2+、Cu2+、AlO2-、ClO- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
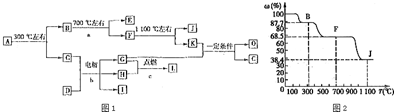
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.
如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
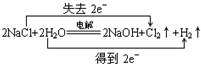
 .
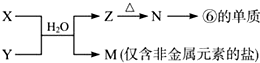
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
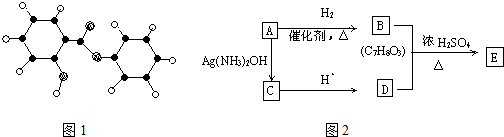

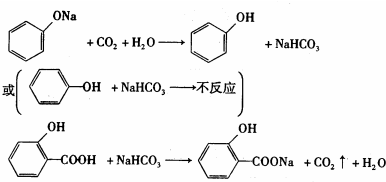 .
.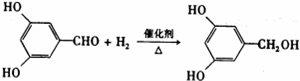 ;反应类型:加成反应.
;反应类型:加成反应.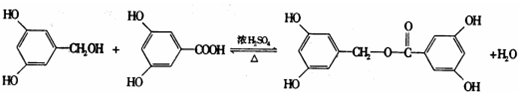 ;反应类型:酯化反应
;反应类型:酯化反应查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成气体的质量可能是11克或33克 | |
| B. | 滤渣中的红色物质可能是32克或96克 | |
| C. | 参与反应的氧化铜质量可能是40克或120克 | |
| D. | 稀硫酸的溶质质量可能是38.4克或115.2克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com