
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
| A、达平衡时,2v 正(A)=v 逆(B) |
| B、温度升高,平衡常数减小 |
| C、将容器改为恒温容器,其他条件不变,达平衡后缩小容器体积,平衡不移动 |
| D、将容器改为恒温容器,其他条件不变,达平衡后 c(C)/c(B)比上述平衡时小 |
| c2(C) |
| c2(A)c(B) |


科目:高中化学 来源: 题型:
| A、0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金的熔点一般比组成合金的各成分金属的高 |
| B、氮化硅、光导纤维、氧化铝陶瓷、玻璃等属于新型无机非金属材料 |
| C、木材、织物浸过水玻璃后具有防腐性能且不易燃烧 |
| D、光导纤维的主要成分是硅,可广泛用于通信和医疗领域 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度正反应加快,逆反应不变 |
| B、升高温度正逆反应都加快 |
| C、升高温度逆反应加快,正反应不变 |
| D、升高温度逆反应加快,正反应减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.1 mol?L-1 盐酸中含NA个HCl分子 |
| B、常温常压下,22.4L NH3含4NA个原子 |
| C、常压、4℃,18mLH2O中含有10NA个电子 |
| D、标准状况下,64 g SO2所含分子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14g N2和32g O2 |
| B、11.2L O2和0.5mol O2 |
| C、2L CO2和2L H2O |
| D、17g NH3和4g H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
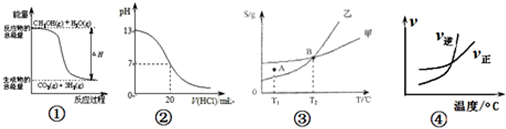 ( )
( )| A、根据图①可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的△H<0 |
| B、图②表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液的pH随加入酸体积的变化 |
| C、根据图③(S表示溶解度),A点表示T1°C时甲为饱和溶液,乙溶液未饱和 |
| D、根据图④可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
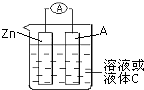 如图所示是组成一种原电池的装置图.试回答下列问题(A为电流表):
如图所示是组成一种原电池的装置图.试回答下列问题(A为电流表):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com