
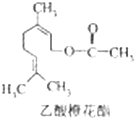
 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( ) | A、①②③ | B、①②⑤ |
| C、①②⑤⑥ | D、①②④⑤⑥ |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
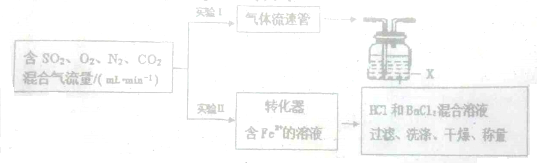
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | Mg | Al | NaOH溶液 | 过滤 |
| C | FeCl2 | FeCl3 | Cu | 过滤 |
| D | MgCl2 | FeCl3 | MgO | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥ | B、③④⑤⑥ |
| C、②④⑤⑥ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com