
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1= 。若温度为400℃,平衡常数为K2,则K1 K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g); △H kJ·mol-1。
又已知:H2(g) +1/2 O2(g)== H2O(l); △H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g);△H2=-283.0kJ/mol
CH4(g) +2 O2(g)== CO2(g)+ 2H2O(l); △H3=-890.3kJ/mol
H2O(g) == H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式 。
② CH4(g)+H2O(g)=CO(g)+3H2(g); △H= kJ/mol
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省陆河外国语学校高二第一次月考化学试卷(带解析) 题型:填空题
(8分)已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ) ,反应过程中能量变化如下图: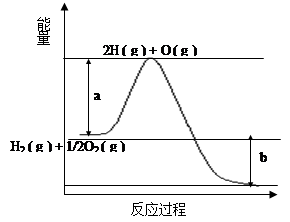
请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应是 反应(填“吸热”或“放热”),△H (填“< 0”或“> 0”)。
查看答案和解析>>
科目:高中化学 来源:09-10年金华市普通高中高一下学期期末考试化学卷 题型:填空题
(6分)今有两个氢气燃烧生成水的热化学方程式
H2(g) + 1/2O2(g) ="=" H2O(g) △H=a kJ/mol
2H2(g) + O2(g) ="=" 2H2O(l) △H=b kJ/mol
请回答下列问题:(提示:︱b︱表示b的绝对值)
(1)若2 mol H2完全燃烧生成水蒸气,则放出的热量 ︱b︱kJ(填“>”、“<”或“=”)
(2)反应热的关系:2a b(填“>”、“<”或“=”)。
(3)若已知H2(g) + 1/2O2(g) ="=" H2O(g) △H=—242 kJ/mol ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H—O键形成时放出热量463kJ,则氢气中1mol
H—H键断裂时吸收的热量为
查看答案和解析>>
科目:高中化学 来源:2014届广东省陆河外国语学高二第一次月考化学试卷(解析版) 题型:填空题
(8分)已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ) ,反应过程中能量变化如下图:
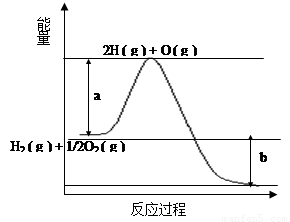
请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应是 反应(填“吸热”或“放热”),△H (填“< 0”或“> 0”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三上学期10月份月考化学试卷 题型:填空题
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1= 。若温度为400℃,平衡常数为K2,则K1 K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g); △H kJ·mol-1。
又已知: H2(g) +1/2 O2(g)== H2O(l); △H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g) ;△H2=-283.0kJ/mol
CH4(g) +2 O2(g)== CO2(g) + 2H2O(l); △H3=-890.3kJ/mol
H2O(g) == H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式 。
② CH4(g)+H2O(g)=CO(g)+3H2(g); △H= kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com