
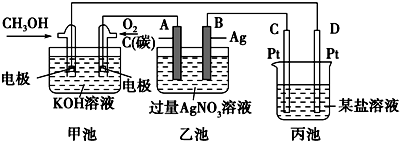
分析 (1)燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)乙池有外接电源是电解池,阳极上水得电子生成氧气和氢离子,阴极上银离子放电,酸性溶液使紫色石蕊试液变红;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,据此写出离子方程式;
(5)根据银和氢离子关系式计算氢离子浓度,从而确定溶液的pH,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素.
解答 解:(1)燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动,故答案为:CH3OH;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4H2O-4e-=O2↑4H+,
故答案为:4H2O-4e-=O2↑4H+;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+,
故答案为:4Ag++2H2O=4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为xmol/L,
4Ag++2H2O=4Ag+O2↑+4H+;
432g 4mol
5.40g 0.5xmol
x=0.1,则溶液的pH=1,
阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素,析出5.40g时转移电子是0.05mol,
A.硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;
B.电解硫酸铜溶液时,阴极上析出1.60g铜需要转移电子0.05mol,故正确;
C.氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;
D.电解硝酸银溶液时,阴极上析出1.60g银需要转移电子0.0148mol<0.05mol,故正确;
故答案为:1;BD.
点评 本题考查了原电池和电解池原理,注意(5)题中,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用C表示的反应速率是0.2 mol/(L•s) | |
| C. | 2 min末的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 2 min内,用B和C表示的反应速率之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铵溶液中滴加氢氧化钡溶液:Ba2++SO42-=BaSO4↓ | |
| B. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| D. | 用NaOH溶液吸收少量Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;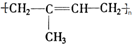 其单体的键线式
其单体的键线式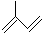 ;
;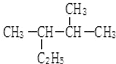 的名称(系统命名法)2,3-二甲基戊烷.
的名称(系统命名法)2,3-二甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com