
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为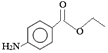 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子中含有3种官能团
B. 1 mol该化合物最多与4 mol氢气发生加成反应
C. 苯环上有2个取代基,且含有硝基的同分异构体有15种
D. 1mol该有机物水解时只能消耗2molNaOH
【答案】C
【解析】由苯佐卡因的结构可知,分子中含有的官能团为氨基和酯基,结合氨基及酯的性质来解答。
A. 由苯佐卡因的结构可知,分子中含有氨基、酯基2种官能团,故A错误;
B. 苯佐卡因中只有苯环能和氢气发生加成反应,所以1mol该化合物最多与3mol氢气发生加成反应,故B错误;
C. 两个取代基可以是硝基和正丙基、硝基和异丙基、-CH2NO2和乙基、-CH2CH2NO2和-CH3、-CH(CH3)NO2和-CH3,各有邻、间、对3种,则符合条件的同分异构体共有15种,故C正确;
D. 1mol苯佐卡因中含有1mol酯基,由苯佐卡因的结构可知,1mol苯佐卡因在NaOH溶液中发生水解反应消耗1molNaOH,故D错误;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)在标准状况下3.2g CO与CO2的混合气体,体积为2.24L。则:混合气体的平均摩尔质量是________ CO2和CO的体积之比是________ CO2和CO的质量之比是_______,混合气体中所含氧原子的物质的量是_______
(2)若10 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有4 g Ca2+,则溶液中NO3-的物质的量浓度为____________
(3)在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为 ____________________
(4)在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有2molH2O参加反应,有_____mol水作还原剂,被水还原的溴元素____________mol;
(5)把V L含MgSO4和K2SO4的混合溶液分成五等份,一份加入含a mol NaOH的溶液恰好使镁离子完全沉淀;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为_______
(6)3.04g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,则该浓硝酸中HNO3的物质的量浓度是 ___mol·L-1,镁的质量为______g,NO2和N2O4的混合气体中,NO2的体积分数是___,得到5.08g沉淀时,加入NaOH溶液的体积是____mL。
(7)在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/3的溴元素被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________mol
(3)装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法正确的是
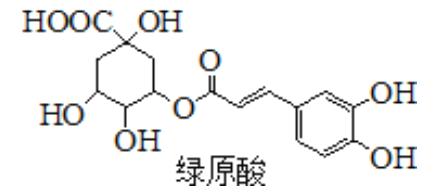
A. 绿原酸中有四个手性碳 B. 绿原酸所有原子可能共平面
C. 1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH D. 1mol奎尼酸最多与5mol溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】q电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×l0-7,K2=4.7×10-11 |
(1) 25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3 溶液、c.CH3COONa 溶液)的pH由大到小的顺序为__________________。(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2, 所发生反应的化学方程式为__________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+ )>c(CN-),下列关系正确的是__________________。
A. c(H+)>c(OH-) B.c(H+)-)
C. c(H+)+c(HCN)= C(OH-) D. c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA 是强酸还是弱酸___________________。
②b组情况表明,C____0.2 (选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)___c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c (OH-)=___mol/L。写出该混合溶液中下列算式的精确结果(不需做近似计算)。c (Na+)-c(A-)=____mol/L。
(5)已知在100℃时,水的离子积为1×10-12,此时将pH=11 的NaOH溶液V1 L与pH=2的H2SO4溶液V2L均匀混合后,若所得混合溶液的pH=10,则V1:V2为_________。
(6)HA为弱酸,在室温下,用蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是____。
A.c(H+)/c(A-) B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值 E.水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是

A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲进行下列实验,其方案设计合理的是( )
A | B | C | D |
检验装置气密性 | 实验室制Fe(OH)2 | 验证浓H2SO4的脱水性、 强氧化性 | 比较NaHCO3和Na2CO3溶解度 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
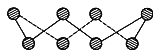
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________。
(2)O、S、Se元素的电负性由大到小的顺序为______________________。
(3)H2Se的酸性比H2S_______(填“强”或“弱”),气态SeO3分子的立体构型为__________。
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________________________;
②H2SeO4比H2SeO3酸性强的原因:____________________________________________。
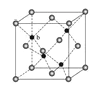
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为________________g·cm-3(列式并计算),(1pm=10-10 cm)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com