
【题目】有机合成是制药工业中的重要手段。G是某抗炎症药物的中间体,其合成路线如下:
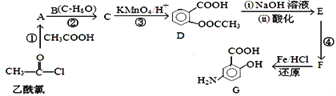
已知: ![]() ;
; ![]()
(1)B的结构简式为____________________。
(2)反应④的条件为____________________;①的反应类型为_______________;反应②的作用是____________________。
(3)下列对有机物G的性质推测正确的是____________(填选项字母)。
A.具有两性,既能与酸反应也能与碱反应
B.能发生消去反应、取代反应和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaOH溶液反应的化学方程式为_____________________________________________。
(5)符合下列条件的C的同分异构体有______________种;
A.属于芳香族化合物,且含有两个甲基
B.能发生银镜反应
C.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:2:1的是_____________________(写出其中一种结构简式)
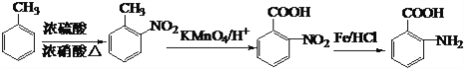
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位;苯环上有羧基时,新引入的取代基连在苯环的间位。根据体重的信息,写出以甲苯为原料合成有机物![]() 的流程图(无机试剂任选)______。合成路线流程图示例如下:X
的流程图(无机试剂任选)______。合成路线流程图示例如下:X![]() Y
Y![]() Z……目标产物
Z……目标产物
【答案】 ![]() 浓硫酸、浓硝酸、加热 取代反应 保护酚羟基,以防被氧化 AC
浓硫酸、浓硝酸、加热 取代反应 保护酚羟基,以防被氧化 AC 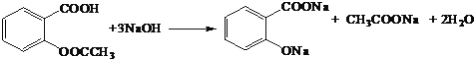 16
16 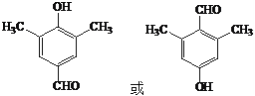
【解析】乙酰氯和乙酸反应生成A,A和B反应生成C,C被酸性高锰酸钾溶液氧化生成D,根据D结构简式知,B为![]() ,C为
,C为![]() ,A为乙酸酐(CH3COOCOCH3),D发生水解反应然后酸化得到E,E为
,A为乙酸酐(CH3COOCOCH3),D发生水解反应然后酸化得到E,E为![]() ,E反应生成F,F发生还原反应生成G,根据G结构简式结合题给信息知,F为
,E反应生成F,F发生还原反应生成G,根据G结构简式结合题给信息知,F为![]() 。
。
(1)B的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)反应④的条件为浓硫酸、浓硝酸和加热;①的反应类型为取代反应;反应②的作用是保护酚羟基,防止被氧化,故答案为:浓硫酸、浓硝酸和加热;取代反应;保护酚羟基,防止被氧化;
(3)A.G中含有羧基和氨基,所以具有酸性和碱性,则具有两性,既能与酸反应也能和碱反应,故正确;B.含有酚羟基,能发生氧化反应,不能发生消去反应,羧基能发生取代反应,故错误;C.含有羧基和酚羟基,所以能发生缩聚反应生成高分子化合物,故正确;D.只有羧基能和碳酸氢钠反应生成二氧化碳,所以1molG与足量NaHCO3溶液反应放出1molCO2,故错误;故选AC;
(4)D与足量的NaOH反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(5)C为![]() ,C的同分异构体符合下列条件:a.属于芳香族化合物,说明含有苯环,且含有两个甲基;b.能发生银镜反应,说明含有醛基;c.与FeCl3溶液发生显色反应,说明含有酚羟基;如果两个-CH3位于邻位、-OH位于-CH3邻位,有3种;如果两个-CH3位于邻位、-OH与一个-CH3间位,有3种;如果两个-CH3位于间位,-OH位于两个-CH3中间,有2种;如果两个-CH3位于间位,-OH与其中一个-CH3邻位,有3种;如果两个-CH3位于间位,-OH与其中两个-CH3间位,有3种;如果两个-CH3位于对位,-OH与其中一个-CH3邻位,有2种;所以符合条件的同分异构体有16种;其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的是
,C的同分异构体符合下列条件:a.属于芳香族化合物,说明含有苯环,且含有两个甲基;b.能发生银镜反应,说明含有醛基;c.与FeCl3溶液发生显色反应,说明含有酚羟基;如果两个-CH3位于邻位、-OH位于-CH3邻位,有3种;如果两个-CH3位于邻位、-OH与一个-CH3间位,有3种;如果两个-CH3位于间位,-OH位于两个-CH3中间,有2种;如果两个-CH3位于间位,-OH与其中一个-CH3邻位,有3种;如果两个-CH3位于间位,-OH与其中两个-CH3间位,有3种;如果两个-CH3位于对位,-OH与其中一个-CH3邻位,有2种;所以符合条件的同分异构体有16种;其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的是 ,故答案为:16;
,故答案为:16; ;
;
(6)甲苯和浓硝酸发生取代反应生成邻硝基甲苯,邻硝基甲苯被酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸被还原生成邻氨基苯甲酸,其合成流程图为 ,故答案为:
,故答案为: 。
。


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是___________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式_______。若去掉C,是否能得出同样结论并解释其原因______________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;___________ | ____________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3,的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为______________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式__________________。
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为_______________。
②滴定终点的现象是_______________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为_______________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2016年9月G20峰会在杭州举行。
①峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于______(填字母,下同)。
a. 有机高分子材料 b. 无机非金属材料 c. 金属材料
②峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是______。
a. 防治酸雨 b. 降低温室效应 c. 保护臭氧层
③央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是______。

a. 可以溶于盐酸 b. 相比纯金币,熔点高 c. 相比纯金币,硬度大
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①紫薯粉中的脂肪在人体内会水解成高级脂肪酸和_______。
②以上营养成分中_______两种元素是人体中含有的微量元素。
③紫薯中的花青素能消耗活性氧,具有_______性(选填“氧化”或“还原”),可用于抗衰老。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式________。
(3)防治环境污染,呵护生态环境是当今社会的主题之一。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是_____。
a.CO和NOx反应的化学方程式为:2xCO+2NOx![]() 2xCO2+N2
2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
室内装修中使用不合格大理石可能会释放放射性气体________。
②通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_____(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
废水处理时通常加入明矾作为混凝剂以吸附水中的杂质,明矾水解的离子方程式为________。
③用过的聚乙烯塑料食品袋要回收处理。聚乙烯的结构简式是_______。
④锂电池为动力的新能源汽车可实现汽车低碳排放,锂电池属于_______电池(选填“一次”或“二次”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应是SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0)。某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0)。某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A. 反应过程中,增大压强能加快反应速率,提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则平衡时,吸收热量为QkJ
C. 将反应的温度由T1升高至T2,则反应的平衡常数K1>K2
D. 当反应吸收热量为0.25QkJ时,生成的HCl恰好能与1 molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“碳”的认识,不正确的是
A. 每个单体都以若干个相连的碳原子构成的碳链为基本骨架
B. 碳是生命的核心元素,没有碳就没有生命
C. 人体细胞鲜重中碳的含量高达55.99%
D. 多数糖类分子中氢原子和氧原子之比都是2:1,因而糖类又称“碳水化合物”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 在常温下浓硫酸与铁不反应,所以可以用铁制容器来装运浓硫酸
B. 侯氏制碱工业是以氯化钠为主要原料,制得大量NaOH
C. 我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅
D. 垃圾分类是化废为宝的重要举措,厨余垃圾可用来制沼气或堆肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日光等白光经棱镜折射后产生的是 __________ 光谱。原子光谱则与之不同,它是由不连续特征谱线组成的,称为 ____________ 光谱。根据原子光谱谱线的分析结果,可以得到的信息是原子轨道能量的变化是不连续的,这种情况又称为原子中电子的能量是 ___________ 的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将下列反应的双线桥写出
(1)8H++2NO3﹣+3Cu=Cu 2++2NO↑+4H2O
(2)KClO3+6HCl=KCl+3Cl2↑+3H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com