
| �� | �� | �� | �� |
| 0.1mol•L-1 NaOH��Һ | pH=11NaOH��Һ | 0.1mo•L-1 CH3COOH ��Һ | pH=3 CH3COOH ��Һ |
| A�� | ����ܻ�ϣ�����Һ�����ԣ���������Һ������Ũ�ȿ���Ϊ��c��CH3COO-����c��H+����c��Na+����c��OH-�� | |
| B�� | ��ˮ�������c��OH-�����٣��� | |
| C�� | ��ϡ�͵�ԭ����100����pH�����ͬ | |
| D�� | ����ۻ�ϣ�����ҺpH=7����V��NaOH����V��CH3COOH�� |
���� A�������£���pH=11NaOH��Һ���pH=3CH3COOH��Һ��ϣ�����Һ�����ԣ���Ϊ�����������Ļ����Һ�����������ڴ��������ˮ�⣬������ڵ���ƽ�⣬�����ǵ������ϣ�Ҳ�����Ǵ����㹻����������϶࣬��c��H+����c��Na+����
B.0.1mol/LNaOH��Һ�У���ˮ�������c��H+��Ϊ10-13mol/L��0.1mol/L CH3COOH��Һ��c��H+����0.1mol/L������ˮ�������c��H+������10-13mol/L��
C����0.1mo•L-1CH3COOH��Һ��������Һ���ڵ���ƽ�⣬c��H+����0.1mol/L����pH��1������Ϊ3��ϡ��100����pH����
D������ۻ�ϣ�����ҺpH=7��c��H+��=c��OH-������������Һ�ʼ��ԣ�Ҫʹ����Һ�����ԣ������Ӧ����������
��� �⣺A������ܻ�ϣ�����Һ�����ԣ���Ϊ�����������Ļ����Һ�����������ڴ��������ˮ�⣬������϶࣬��c��H+����c��Na+������ϵ���غ��֪��Һ������Ũ�ȿ���Ϊc��CH3COO-����c��H+����c��Na+����c��OH-������A��ȷ��
B����0.1mol•L-1NaOH��Һ��ǿ����Һ����0.1mo•L-1CH3COOH��Һ��������Һ���������ˮ�ĵ��룬�����������Ƴ̶ȴ�ˮ���������������Ũ��С���٣��ۣ���B����
C.0.1mol/L CH3COOH��Һ��c��H+����0.1mol/L����pH��1������Ϊ3��ϡ��100����pH������۵�pH������ܲ�ͬ����C����
D������ۻ�ϣ�����ҺpH=7��c��H+��=c��OH-�����ɵ���غ��֪c��CH3COO-��=c��Na+������Ϊ����ʹ����ƵĻ��Һ�������������NaOH��Һ��������������������ɣ�����V��NaOH����V��CH3COOH������D����
��ѡA��
���� ���⿼�������pH���жϼ���Һ����Եķ�����ѡ��CΪ�����ѵ㣬ע�������ʱpH��Ũ�ȵĹ�ϵ��������ˮ��Ĺ�ϵ�ȼ��ɽ����Ŀ�ѶȽϴ�


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AgNO3��Һ | B�� | NaOH��Һ | C�� | ���� | D�� | KNO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L0.2mol/L CaCl2��Һ�к�Cl-��Ϊ0.2��6.02��1023 | |
| B�� | 22gCO2����0.5mol CO2���ӣ����Ϊ11.2L | |
| C�� | 3.01��1023��ˮ���ӵ�Ħ������Ϊ9g/mol | |
| D�� | 3.2g O2��3.2g O3����ԭ�ӵ���Ŀ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
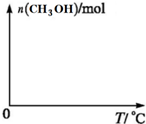 ��֪�Ʊ��״����йػ�ѧ��Ӧ��ƽ�ⳣ�������ʾ��
��֪�Ʊ��״����йػ�ѧ��Ӧ��ƽ�ⳣ�������ʾ��| ��ѧ��Ӧ | ��Ӧ�� | ƽ�ⳣ����850�棩 |
| ��CO2 ��g��+3H2 ��g���TCH3OH��g��+H2O��g�� | ��H1=-48.8 kJ•mol��1 | K1=320 |
| ��CO��g��+H2O��g���TH2��g��+CO2��g�� | ��H2=-41.2 kJ•mol��1 | K2 |
| ��CO��g��+2H2��g���TCH3OH��g���� | ��H3 | K3=160 |
| ���� | H2 | CO2 | CH3OH | H2O |
| Ũ�ȣ�mol•L��1�� | 0.2 | 0.2 | 0.4 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ͼ״���Ӧ�Ƶã�
���ͼ״���Ӧ�Ƶã�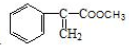
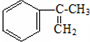 �����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᣮ
�����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᣮ ��
��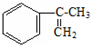 ������̼ԭ�ӵ�һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ
������̼ԭ�ӵ�һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ ��
�� �ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ
�ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ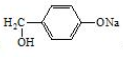 ��
��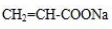 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ����ʱ���Ƚ���Һ©���е��²�Һ��ų����ٽ��ϲ�Һ����ŷų� | |
| B�� | ����������ʹNaCl����Һ������ʱ��Ӧ����������NaCl��Һȫ���������� | |
| C�� | ����ʵ�����¶ȼƵ�ˮ����Ӧ����Һ̬������� | |
| D�� | ����ʱ��������ĩ��Ӧ�����������ֽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


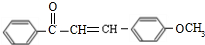 ����Ҫ�������칹����
����Ҫ�������칹���� ��
��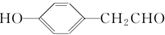 ��д�ṹ��ʽ����
��д�ṹ��ʽ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com