
| A、K | B、Al | C、He | D、S |


科目:高中化学 来源: 题型:
| A、S(g)+O2(g)═SO2(g);△H1 S(s)+O2(g)═SO2(g);△H2 | ||||
B、
| ||||
| C、2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | ||||
D、C(s)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、芳香烃可以来自于煤干馏产品中的煤焦油 |
| B、聚氯乙烯可用于制作食品包装袋 |
| C、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 |
| D、在铁的吸氧腐蚀中,负极是炭,电极反应为2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、都能与Na2CO3溶液反应产生CO2 |
| B、一定条件下,均能与乙醇发生取代反应 |
| C、只有桂皮酸可与溴的四氯化碳溶液发生加成反应 |
| D、1mol阿司匹林最多能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 +C2H5Cl→ +C2H5Cl→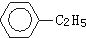 +HCl +HCl |
B、 +C2H5OH→ +C2H5OH→ +H2O +H2O |
C、 +CH2═CH2→ +CH2═CH2→ |
D、 +CH3CH3→ +CH3CH3→ +HCl +HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g?L-1 |
| 排放标准 | pH6~9 | 0.5mg?L-1 |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| H2(g) | Br2(l) | HBr(g) | |
| 1mol 分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
| A、404 | B、344 |
| C、260 | D、200 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com