
【题目】下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40g
B.1molNaOH的质量是40g/mol
C.1gH2和1gN2所含分子数相等
D.等物质的量的N2、CH4中,所含分子数一样多
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是

A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.21 NA
C. 原苛性钾溶液中KOH的物质的量无法确定
D. 生成物中Cl- 的物质的量为 0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NiS、FeS沉淀溶解平衡曲线如图所示(已知NiS的溶解度比FeS小,lg2=0.3),图中p(S2-)=-lgc(S2-)、p(M2+)=-lgc(M2+),M表示Ni或Fe,下列说法不正确的是

A. 曲线①表示的是NiS
B. d点分别对应的NiS和FeS的分散系均是均一稳定的
C. 25℃时,FeS+Ni2+![]() NiS+Fe2+的平衡常数K=4000
NiS+Fe2+的平衡常数K=4000
D. 向a点溶液中加入硫化钠,可变为b点溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
A. 增大压强,平衡正向移动,此反应的ΔH仍保持不变
B. 增大O2浓度,SO2的平衡转化率减小
C. 降低温度,化学平衡常数减小
D. 升高温度,SO2的转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
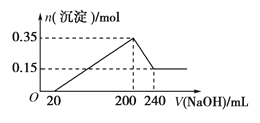
(1)加入NaOH 0~ 20mL 时发生反应离子方程式___________________,
加入NaOH 20~ 200mL 时发生反应离子方程式___________________,
加入NaOH 200~ 240mL 时发生反应离子方程式___________________,
(2)镁和铝的总质量为________g
(3)硫酸的物质的量浓度为___________ mol/L
(4)生成的氢气在标准状况下的体积为__________L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com