
A、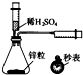 测定一定时间内生成H2的反应速率 |
B、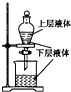 提取海带中的碘 |
C、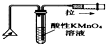 检验火柴燃烧产生的SO2 |
D、 证明非金属性:Cl>C>Si |


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
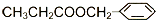 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下: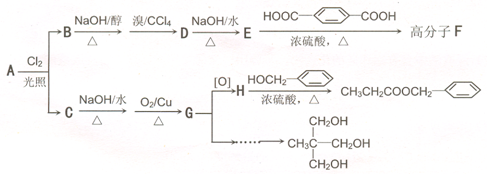

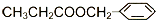 互为同分异构体的是:
互为同分异构体的是: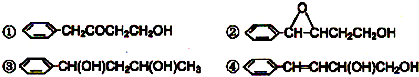
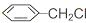 直接合成该香精,化学方程式为
直接合成该香精,化学方程式为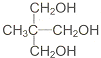 ,写出合成路线(注明条件,不要求写化学方程式)
,写出合成路线(注明条件,不要求写化学方程式)查看答案和解析>>
科目:高中化学 来源: 题型:
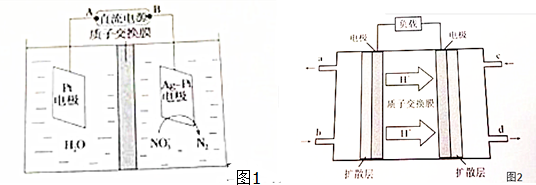
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
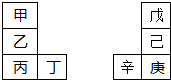
| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于20mL |
| B、小于20mL |
| C、等于30mL |
| D、大于30ml. |
查看答案和解析>>
科目:高中化学 来源: 题型:
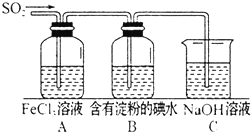 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com