
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | Mg | Al | NaOH | 过滤 |
| C | FeCl2 | FeCl3 | Cu | 过滤 |
| D | KNO3 | KCl | H2O | 冷却结晶 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氧化铁与盐酸反应,而二氧化硅不能;
B.Al与NaOH溶液发言,而Mg不能;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜;
D.二者溶解度受温度影响不同.
解答 解:A.氧化铁与盐酸反应,而二氧化硅不能,则加足量盐酸、过滤可除杂,故A正确;
B.Al与NaOH溶液发言,而Mg不能,则加足量NaOH溶液、过滤可除杂,故B正确;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜,引入新杂质不能除杂,应选铁粉、过滤,故C错误;
D.二者溶解度受温度影响不同,则加水、冷却结晶可除杂,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| B. | 电解精炼铜时,每转移1mol电子,阳极溶解铜的质量为32g | |
| C. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 | |
| D. | 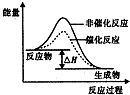 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| B. | 能使pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、CO32-、OH- | |
| D. | 能使淀粉KI试纸显蓝色的溶液:K+、SO42-、Fe2+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com