
| A. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算. | |
| B. | 蒸馏时可用多种方法控制温度,用水浴加热分离碘并回收苯时,实验结束后,碘留在蒸馏烧瓶中. | |
| C. | 金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠保存在煤油中,白磷则可保存在水中. | |
| D. | 工业上电解饱和和盐水时,从安全性和综合效率角度考虑,往往用阴离子交换膜把阳极和阴极隔开 |
分析 A.分光光度计是根据溶液颜色与反应物(或生成物)浓度的关系(即比色分析)来分析使用的仪器;
B.水浴加热分离碘并回收苯时,苯的沸点低;
C.钠和钾密度大于煤油,保存在煤油中,白磷溶于煤油中,着火点低,不和水反应保存在水中隔离空气;
D.常将两个极室用离子膜隔开.
解答 解:A.分光光度计可测定溶液颜色与反应物(或生成物)浓度的关系,则通过分光光度计用比色法测出不同反应时刻的浓度来计算反应速率,故A正确;
B.水浴加热分离碘并回收苯时,苯的沸点低,则苯回收在锥形瓶中,而碘在实验结束后留在蒸馏烧瓶中,故B正确;
C.钠和钾密度大于煤油,保存在煤油中,白磷溶于煤油中,着火点低,不和水反应保存在水中隔离空气,则为防止钾、钠和白磷等暴露在空气中燃烧,所以金属钾、钠保存在煤油中,白磷则可保存在水中,故C正确;
D.工业上电解饱和和盐水时,从安全性和综合效率角度考虑,常将两个极室用离子膜隔开,防止H2与Cl2混合爆炸,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率、蒸馏、试剂保存、电解原理等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的综合考查,注意实验的评价性分析,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
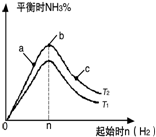 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
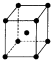 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
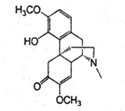
| A. | 每个青藤碱分子中含有2个手性碳原子 | |
| B. | 1mol最多能与1molBr2发生反应 | |
| C. | 1mol最多能与4molH2发生反应 | |
| D. | 青藤碱既能与盐酸反应又能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阿司匹林的分子式是:C9H8O4 | |
| B. | 阿司匹林可以通过邻羟基苯甲酸与乙酸酯化反应制备,乙酸的用量应过量,可以提高邻羟基苯甲酸的转化率,同时也起到了溶剂的作用 | |
| C. | 原子经济性反应指原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放,则阿司匹林制备符合原子经济性 | |
| D. | 阿司匹林分子中所有碳原子可以共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙、丙、丁 |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 基本营养物质 | 蛋白质、维生素、糖类 |
| ④ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ⑤ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑥ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ①⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com