
| A、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| B、若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9mol/L |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
| 0.2mol-0.1mol |
| 2L |


科目:高中化学 来源: 题型:
时间(h) 钾元素 温度 熔出率 |
1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硅酸钠溶液中通入过量的CO2:SiO32-+2CO2+3H2O=H4SiO4↓+2HCO3- |
| B、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+ |
| C、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6I -=2Fe2++3I2+3H2O |
| D、过量铁粉与稀HNO3反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
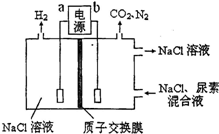
| A、电源的正极为b |
| B、尿素被氧化的化学方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl |
| C、电解结束后,阴极室溶液与电解前相比pH增大 |
| D、阳极收集到气体4.48L(标准状况)时,被氧化的尿素为6.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关 |
| B、蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C、通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D、乙醇、乙酸均能与Na反应放出H2,二者分子中官能团种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向澄淸石灰水中通人过量的CO2:OH-+CO2=HCO3- |
| B、在海带灰的浸出液(含有I)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O |
| C、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═A1O2-+4NH4++2H2O |
| D、硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42++Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L氯化铜溶液中的Cu2+数小于NA |
| B、标准状况下,22.4L Cl2参加任何化学反应转移的电子数都是2NA |
| C、28 g聚乙烯含有的碳原子数为2NA |
| D、1mol CH5+所含电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com