
| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为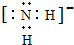 .
.分析 由短周期元素X、Y、Z、W在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,在同周期元素的常见简单离子中,W的简单离子半径最小,则W为Al,可推知X为C、Y为N、Z为O.
(1)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-;
(2)(3)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,电流由正极通过导线流向负极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大.
解答 解:由短周期元素X、Y、Z、W在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,在同周期元素的常见简单离子中,W的简单离子半径最小,则W为Al,可推知X为C、Y为N、Z为O.
(1)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-,NH2-中N原子与H原子之间形成1对共用电子对,其电子式为: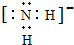 ,故答案为:
,故答案为: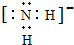 ;
;
(2)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO-2e-+O2-═CO2,
故答案为:CO-2e-+O2-═CO2;
(3)A.工作时电极b通入空气,b作正极,阴离子向负极移动,O2-由电极b流向电极a,故A正确;
B.原电池放电时电子从负极流向正极,故电流由电极b通过传感器流向电极a,故B错误;
C.一氧化碳的含量越大,原电池放电时产生的电流越大,故C正确,
故答案为:AC.
点评 本题考查结构性质关系应用,涉及电子式、原电池等,推断应是解题关键,侧重对学生综合能力与基础知识的掌握.


科目:高中化学 来源: 题型:选择题
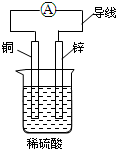
| A. | 锌片为负极,铜片为正极 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 铜片发生的反应为Cu-2e-═Cu2+ | |
| D. | 电流方向是由锌片通过导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
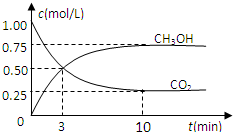 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
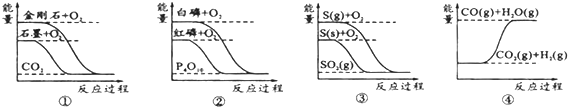
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,等质量S(g)和S(s)的能量比较,S(s)能量较高 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,CO2
,CO2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com