
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
分析 短周期元素中,B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,则B为N元素;由元素的相对位置可知,A为碳元素,C为O元素,D为Al,E为Si,F为S,G为Cl.结合元素化合物的性质和元素周期律分析解答.
解答 解:短周期元素中,B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,则B为N元素;由元素的相对位置可知,A为碳元素,C为O元素,D为Al,E为Si,F为S,G为Cl.
A.G为Cl,最高价氧化物对应的水化物为高氯酸,属于强酸,故A正确;
B.Al2O3属于了离子化合物,熔融电解化合物Al2O3可制取单质Al,故B正确;
C.F为S元素,其最高价含氧酸的浓溶液浓硫酸与单质碳共热时能生成二氧化硫、二氧化碳和水,故C正确;
D.C、Cl分别与氢元素形成的化合物中,可能含有非极性键,如CH3CH2Cl中含有C-C非极性键,故D错误,
故选:D.
点评 本题考查结构性质位置关系应用,难度不大,根据位置判断元素所处的周期是推断关键,注意掌握元素周期表的结构与元素周期律.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

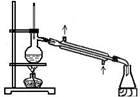
| A. | 甲装置:可用来证明硫的非金属性比硅强 | |
| B. | 乙装置:用盐酸标准液测氢氧化钠溶液浓度 | |
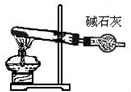
| C. | 丙装置:配制一定物质的量浓度的氢氧化钠溶液 | |
| D. | 丁装置:可在瓶中先装满水,气体由②口入,收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 分离苯和硝基苯的混合物 | 吸收HCl气体,并防止倒吸 | 以NH4Cl为原料制取NH3 | 制取乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、双氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸铜中铜离子:S2-+Cu2+═CuS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
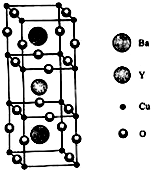 铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com