
��֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���42��XԪ��ԭ�ӵ�4p�������3��δ�ɶԵ��ӣ�YԪ��ԭ�ӵ������2p�������2��δ�ɶԵ��ӡ�X��Y���γɻ�����X2Y3��ZԪ�ؿ����γɸ�һ�����ӡ���ش��������⣺
��1��XԪ��ԭ�ӻ�̬ʱ�ĵ����Ų�ʽΪ ����Ԫ�صķ����� ��
��2��ZԪ�������ڱ����� ������s��p��d���������Ԫ���� ��ͬλ�أ�
��3��X��Z���γɻ�����XZ3���û�����Ŀռ乹��Ϊ ��
��4����֪������X2Y3��ϡ������Һ�пɱ�����п��ԭΪXZ3�����ﻹ��ZnSO4��H2O���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��5��X���⻯����ͬ��ڶ�����������Ԫ�����γɵ��⻯���ȶ��ԡ��е�ߵ�˳��ֱ��ǣ��û�ѧʽ��ʾ�� �� ��
 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꼪��ʡ��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������£�ij������X���ȷֽ�:4X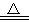 A��+2B��+4C������÷�Ӧ�����ɵĻ�������H2������ܶ�Ϊ11.43������ͬ�����£�X����Է�������Լ��( )
A��+2B��+4C������÷�Ӧ�����ɵĻ�������H2������ܶ�Ϊ11.43������ͬ�����£�X����Է�������Լ��( )
A��11. 43 B��40.01 C��80.01 D��160.02
43 B��40.01 C��80.01 D��160.02
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꼪��ʡ�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ԭ��صĵ缫���Ʋ�����缫���ϵ������й�,Ҳ��������Һ�йأ�����˵���в���ȷ���ǣ� ��
A����Al��Cu��ϡH2SO4���ԭ���,�为����ӦʽΪ��Al-3e-��Al3+
B����Mg��Al��NaOH��Һ���ԭ���,�为����ӦʽΪ��Al-3e-+4OH-��AlO2-+2H2O
C����Fe��Cu��FeCl3��Һ���ԭ���,�为����ӦʽΪ��Cu-2e-��Cu2+
D����Al��Cu��Ũ�������ԭ���,�为����ӦʽΪ��Cu-2e-��Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ��ɽ�и�һ��ѧ�ڽ�ѧ�ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
A��78 g Na2O2������CO2��ַ�Ӧʱ����ת����ΪNA
B��2.24L O2�ķ�����ԼΪ0.1NA
C���ڱ�״����,2.24L H2O���еķ�����0.1NA
D��0.1mol/L NaOH��Һ��������Na+Ϊ0.1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ��ɽ�и�һ��ѧ�ڽ�ѧ�ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ��Ƽ�����ᡢ����������ء������й�˵���У�����ȷ���ǣ� ��
A�������Ļ�ѧ���ʲ����ã���������ʳ��ʳƷ�ֿ�ı�����
B����������ˮ�ɲ������������ԵĽ������ӣ�����������ˮ��ɱ������
C���ƹ�ʹ��ȼú����������Ҫ��Ϊ�˷���SO2��Ⱦ
D���赥����������ء�CPU����Ҫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ��ɽ�и߶���ѧ�ڽ�ѧ�ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ�У���H����ȷ��ʾ���ʵ�ȼ���ȵ���  �� ��
�� ��
A��CO(g) +1/2O2(g) =CO2(g) ��H��-283.0 kJ/mol
B��C(s) +1/2O2(g) =CO(g) ��H��-110.5 kJ/mol
C��H2(g) +1/2O2(g)=H2O(g) ��H��-241.8 kJ/mol
D��2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l) ��H��-11036 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ��ɽ�и߶���ѧ�ڽ�ѧ�ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A�����Ӿ�����һ�����ڷ��Ӽ�����������һ�����ڹ��ۼ�
B�������к�������ԭ�ӵ���һ���Ƕ�Ԫ��
C���Ǽ��Է�����һ�����зǼ��Լ�
D��Ԫ�صķǽ�����Խǿ���䵥�ʵĻ�����һ��Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ����У�߶��ϵڶ���������ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ��pH = 9��NaHA��Һ�и��������ʵ���Ũ�ȹ�ϵ��ȷ����
A��c(A2-)>c(H2A) B��c(Na+)+c(H+) =c(OH-)+c(HA-)+2c(A2-)
C��c(Na+) =c( HA-) +c(H2A) D��c(H+) =c(A2-) +c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������ʡ�����ж����ظ߶�12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�д��ڵ���ƽ��CH3COOH 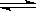 H����CH3COO����������������ȷ����( )
H����CH3COO����������������ȷ����( )
A��������Һ������Ũ�ȵĹ�ϵ���㣺c��H +����c��OH������c��CH3COO����
+����c��OH������c��CH3COO����
B��0.10mol/L��CH3COOH��Һ�м�ˮϡ�ͣ���Һ��c��OH������С
C��CH3COOH��Һ�м�������CH3COONa���壬ƽ�������ƶ�
D��������pH��2��CH3COOH��Һ��pH��12��NaOH��Һ�������Ϻ���Һ��pH��7
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com