
| A. | 从柑桔中可提炼出苧烯(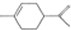 ),其分子式为C10H16,是1,3丁二烯的同系物 ),其分子式为C10H16,是1,3丁二烯的同系物 | |
| B. | 化学式为C4H10O的醇可被氧化成醛的有2种 | |
| C. | 2-氯丁烷(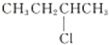 )与NaOH乙醇溶液共热发生消去反应的产物有2种 )与NaOH乙醇溶液共热发生消去反应的产物有2种 | |
| D. | 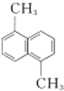 与 与 的一氯代物的数目不相等 的一氯代物的数目不相等 |
分析 A.1,3-丁二烯是链状二烯烃,而该有机物中含有环;
B.分子式为C4H10O属于醇类的有机物中,能被氧化生成醛,说明与羟基相连的碳上有2个氢原子,即具有-CH2OH结构的醇;
C.消去反应的实质是和相邻碳原子上的氢原子消去小分子形成双键;
D.有几种等效氢原子就有几种一氯代物.
解答 解:A.1,3-丁二烯是链状二烯烃,而该有机物中含有环,二者的结构不同,不是同系物,故A错误;
B.分子式为C4H10O属于醇类的有机物即C4H9OH中,能被氧化生成醛,说明与羟基相连的碳上有2个氢原子,丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,其中与羟基相连的碳上有2个氢原子的是:-CH2CH2CH2CH3、-CH2CH(CH3)2,所以该有机物的可能结构有2种,故B正确;
C.2-氯丁烷(CH3CH2CClHCH3)与NaOH乙醇溶液共热发生消去HCl分子的反应,可以从1号碳上消去氢原子形成双键,也可以从3号碳原子上消去氢原子形成双键,所以消去反应能生成两种结果不同的同分异构体,故C正确;
D. 与
与 的一氯代物分别为4种和3种,故D正确.
的一氯代物分别为4种和3种,故D正确.
故选A.
点评 本题考查同系物、有机物的推断、同分异构体的书写等,难度中等,B中利用烃基异构判断,比书写丁醇的同分异构体简单容易,为易错点.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌跟稀硫酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 碳酸钙中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 单质氯气与水的反应:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1 mol•L-1的Na2SO3溶液490mL,需用500ml容量瓶 | |
| B. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) | |
| C. | 在标准状况下,将22.4L氨气溶于1L水中,得到1mol•L-1的氨水 | |
| D. | 10mL质量分数为70%的乙醇用10mL水稀释后;乙醇的质量分数小于35% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
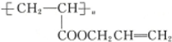 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )| A. | CH3CH2CH2OH | B. | CH2═CHCH2OH | C. | 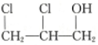 | D. | 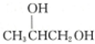 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | 氨水中滴入酚酞溶液,溶液变红:NH3•H2O=NH4++OH- | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
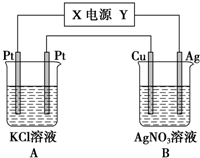 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com