

 NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动

 2NH3↑+CaCl2+2H2O (2)①c ②3
2NH3↑+CaCl2+2H2O (2)①c ②3

科目:高中化学 来源:不详 题型:单选题
| A.所得溶液的物质的量浓度:c=1 mol·L-1 |
| B.所得溶液中含有NA个HCl分子 |
| C.36.5 g HCl气体占有的体积为22.4 L |
| D.所得溶液的质量分数:W=36.5 c/(1 000ρ) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含1 mol溶质的任何溶液,物质的量浓度一定相等 |
| B.配制1 mol·L-1NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中 |
| C.体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 |
| D.1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.24 L CO2中共有的原子数为0.3×6.02×1023 |
B.1.8 g N 共有的质子数为6.02×1023 共有的质子数为6.02×1023 |
| C.1 mol重水分子所含中子数为10×6.02×1023 |
| D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol Al3+含有的核外电子数为3NA |
| B.1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C.室温下,10 L pH=1的硫酸溶液中含有的H+数为2NA |
| D.室温下,10 L pH=13的NaOH溶液中含有的OH-数为NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,2.24 L Cl2完全溶于足量的水中,转移电子的数目为0.1NA |
| B.常温常压下,11.0g C3H8中含有共价键的数目为2.5NA |
| C.常温常压下,1 L 0.1 mol·L-1 NH4NO3溶液中NO3-的数目为0.1NA |
| D.30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol羟基与17 g NH3所含电子数都为NA |
| B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6NA |
| C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g |
| D.适量铜粉溶解于1 L 0.5 mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
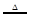 B+2C+2D,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为
B+2C+2D,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为 | A.2d | B.10d | C.5d | D.0.8d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com