
【题目】下列各组物质中,互为同分异构体的是( )
A.淀粉和纤维素 B.葡萄糖和麦芽糖
C.蔗糖和麦芽糖 D.蛋白质与氨基酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以下物质按照强电解质、弱电解质、非电解质、能导电的顺序排列的选项是
A. 氯化氢 氨气 甲烷 铜
B. H2SO4 HF 乙醇 氯化钠溶液
C. 氢氧化钡 氢氧化钙 二氧化碳 氨水
D. 氯化氢 食醋 葡萄糖 银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 白色污染是指橡胶造成的污染
B. 硫和氮的氧化物是形成酸雨的主要物质
C. 汽车尾气的排放是造成温室效应的罪魁祸首
D. 含磷洗涤剂的使用是造成水体富营养化的唯一原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将22.4 L HCl溶于水配制1 L溶液,其溶质的物质的量浓度为1.0 mol/L
B.1 mol/L的Na2CO3溶液中含有2 mol Na+
C.500 mL 0.5 mol/L的(NH4)2SO4溶液中含有NH4+个数为0.5NA(NA为阿伏加德罗常数)
D.Na+浓度为0.2 mol/L的Na2SO4溶液中SO42-浓度为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的5倍,G的3d轨道有3个未成对电子,请回答下列问题:
(1)F的基态原子电子排布式为 ,G在周期表的位置 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答),A、C、D形成的离子化合物中的化学键类型 。
(3)下列关于B2A2(B原子最外层满足8电子稳定结构)分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)用电子式表示E的氯化物的形成过程 。
(5)F的最高正价为+6价,而氧原子最多只能形成2个共价键,试推测CrO5的结构式________。
(6)C的最低价的氢化物为CH3,通常情况下,G2+的溶液很稳定,它与CH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[G(CH3)6]3+,该反应的离子方程式是 ,1 mol [G(CH3)6]3+配离子含有σ键数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取法有:
Ⅰ.空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:①Cl2+2Br-===Br2+2Cl-
②3Br2+3C![]() ===Br
===Br![]() +5Br-+3CO2↑;
+5Br-+3CO2↑;
③Br![]() +5Br- +6H+===3Br2+3H2O
+5Br- +6H+===3Br2+3H2O
其中②中的氧化剂是________,③中的还原剂是________。
Ⅱ.空气吹出SO2吸收法。该方法基本同(Ⅰ),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
写出溴与二氧化硫反应的化学方程式_________________________________________________。
Ⅲ.溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。
实验室中萃取用到的主要实验仪器名称是_______________________。
下列可以用于海水中溴的萃取的试剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
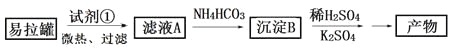
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5·H2O和Fe3O4。
(1)铁元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。
(2)以硼酸为原料可制得NaBH4 ,B原子的杂化方式为 。
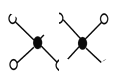
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“否”)平面型分子。
(4)Al单质为面心立方晶体,其晶胞的边长a=0.405nm,列式表示Al单质的密度:____g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com